
题目列表(包括答案和解析)
过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。
请回答下列问题:
(1)用氨水调节pH至8——9的目的是 。
(2)若测得滤液C中c(CO32-)=10-3mol/L,则Ca2+ (填“是”或“否”)沉淀完全。(已知c(Ca2+)≤10-5mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9)
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH4+) c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)。
(4)在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式: ,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9——11,才出现大量沉淀。用化学方程式和简要的文字解释需用氢氧化钠调节pH至9——11的原因 。
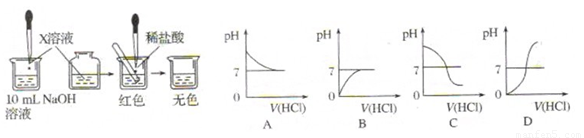
某校兴趣小组对氢氧化钠溶液和稀盐酸混合后的有关问题,进行了如下探究:
Ⅰ.(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如图所示
实验。
X溶液是 ,滴入的量一般为 。
(2)乙同学也设计完成了另一个实验,证明氢氧化钠溶液与盐酸能够发生反应。在盛有氢氧化钠溶液的试管中,用胶头滴管慢慢滴入稀盐酸,不断振荡溶液,同时测定溶液的pH,直至盐酸过量。
①写出测定溶液pH的方法: 。
②上图中哪个图像符合该同学的记录 (填序号)。
(3)你认为甲、乙两位同学的实验中, (填“甲同学”、“乙同学”或“甲、乙两同学”)的实验能充分证明氢氧化钠溶液与盐酸发生了反应,请说明理由: 。
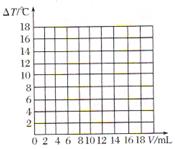
Ⅱ.丙同学测出10mL 10%的NaOH溶液和不同体积的10%的盐酸溶液混合过程中,溶液的温度变化见下表(假设两溶液密度相同)。
| 加入盐酸的 体积( | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 |
| 溶液温度上升 | 5.2 | 9.6 | 12.0 | 16.0 | 18.2 | 16.7 | 15.7 | 14.7 | 13.7 |
就此实验回答:
(4)盐酸和氢氧化钠的反应是 (填“吸热”或“放热”)反应。
(5)请在图中绘制出溶液的温度上升与加入盐酸体积之间的变化关系图,并在曲线上画出能表示两者之间恰好完全反应的点,并用字母P表示。
Ⅲ.丁同学为测定标示质量分数为32%的盐酸的实际质量分数,用pH测定仪组成实验装置。实验时先在烧杯中加入20g 40%的氢氧化钠溶液,再逐滴加入该盐酸,pH测定仪打印出加入盐酸的质量与烧杯中溶液的pH关系如图所示。
(6)请以此次测定的结果为依据计算该盐酸的实际质量分数为 。
(7)请分析你的计算结果与标签标示的质量分数不一致的可能原因(若一致,此空可不填): 。
某校兴趣小组对氢氧化钠溶液和稀盐酸混合后的有关问题,进行了如下探究:
Ⅰ.(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如图所示
实验。
X溶液是 ,滴入的量一般为 。
(2)乙同学也设计完成了另一个实验,证明氢氧化钠溶液与盐酸能够发生反应。在盛有氢氧化钠溶液的试管中,用胶头滴管慢慢滴入稀盐酸,不断振荡溶液,同时测定溶液的pH,直至盐酸过量。
①写出测定溶液pH的方法: 。
②上图中哪个图像符合该同学的记录 (填序号)。
(3)你认为甲、乙两位同学的实验中, (填“甲同学”、“乙同学”或“甲、乙两同学”)的实验能充分证明氢氧化钠溶液与盐酸发生了反应,请说明理由: 。
Ⅱ.丙同学测出10mL 10%的NaOH溶液和不同体积的10%的盐酸溶液混合过程中,溶液的温度变化见下表(假设两溶液密度相同)。
|
加入盐酸的 体积( |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
|
溶液温度上升 |
5.2 |
9.6 |
12.0 |
16.0 |
18.2 |
16.7 |
15.7 |
14.7 |
13.7 |
就此实验回答:
(4)盐酸和氢氧化钠的反应是 (填“吸热”或“放热”)反应。
(5)请在图中绘制出溶液的温度上升与加入盐酸体积之间的变化关系图,并在曲线上画出能表示两者之间恰好完全反应的点,并用字母P表示。
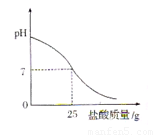
Ⅲ.丁同学为测定标示质量分数为32%的盐酸的实际质量分数,用pH测定仪组成实验装置。实验时先在烧杯中加入20g 40%的氢氧化钠溶液,再逐滴加入该盐酸,pH测定仪打印出加入盐酸的质量与烧杯中溶液的pH关系如图所示。
(6)请以此次测定的结果为依据计算该盐酸的实际质量分数为 。
(7)请分析你的计算结果与标签标示的质量分数不一致的可能原因(若一致,此空可不填): 。
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-12 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com