
题目列表(包括答案和解析)
(13分) 如图所示,各物质间有下列转化关系: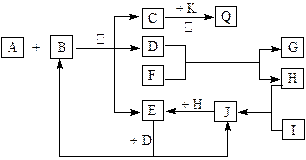
A、F分别为淡黄色固体,A与B的浓溶液反应可以生成C、D、E三种物质,D为无色液体,K为红色金属单质,能在加热条件下与C的浓溶液反应,生成气体Q。I和H为气态双原子分子。反应过程中部分条件和产物均略去。
(1) I的电子式:____________________。
(2) 反应A + B的化学方程式:_________________________________________________。
(3) 将Q和E按2∶1同时通入品红溶液中,若产物之一含I,则现象可能为___________,原理是(用化学方程式表示)______________________________________________。
(4) 若标准状况下将11.2 L Q通入到500 mL 1.5 mol /L 的G溶液中,请将最终溶液的溶质成分及物质的量填入下表(可不填满)。
| 溶质(化学式) | 物质的量 |
| | |
| | |
| | |
(13分) 如图所示,各物质间有下列转化关系:
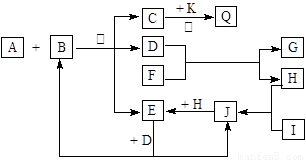
A、F分别为淡黄色固体,A与B的浓溶液反应可以生成C、D、E三种物质,D为无色液体,K为红色金属单质,能在加热条件下与C的浓溶液反应,生成气体Q。I和H为气态双原子分子。反应过程中部分条件和产物均略去。
(1) I的电子式:____________________。
(2) 反应A + B的化学方程式:_________________________________________________。
(3) 将Q和E按2∶1同时通入品红溶液中,若产物之一含I,则现象可能为___________,原理是(用化学方程式表示)______________________________________________。
(4) 若标准状况下将11.2 L Q通入到500 mL 1.5 mol /L 的G溶液中,请将最终溶液的溶质成分及物质的量填入下表(可不填满)。
|
溶质(化学式) |
物质的量 |
|
|
|
|
|
|
|
|
|
(13分)已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色。各物质的转化关系如下图(部分反应物已略去)。
请回答下列问题:
(1)E的化学式为_______________(2分)。
(2)将M丝插入盛有X溶液的试管中,反应一段时间后的现象是_______________(2分)。
(3)在反应①②③④中属于置换反应的是__________(填序号)(2分)。
(4)反应②的离子方程式为______________________________________________(2分)。
(5)用石墨作电极电解50mL X溶液,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;电解一段时间后,取出A电极,洗涤、干燥、称量,电极增重1.6g。请回答下列问题:
①写出电解时的阳极反应式________________________________________(2分)。
②电解后溶液的pH为_______________________________(3分)(假设电解前后溶液体积不变)。
[化学-物质结构与性质]13分
(1)元素的第一电离能:Al Si(填“>”或:“<”)
(2)基态Mn2+的核外电子排布式为 。
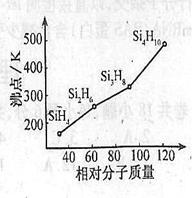
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如右图所示,呈现这种变化关系的原因是 。
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm—(含B、O、H三种元素)的球棍模型如右下图所示:
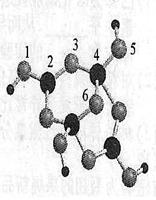
①在Xm—中,硼原子轨道的杂化类型有 ;配位键存在于 原子之间(填原子的数字标号);
m= (填数字)。
②硼砂晶体由Na+、Xm—和H2O构成,它们之间存在的作用力有 (填序号)。
A.离子键 B.共价键 C.金属键
D.范德华力 E.氢键
(13分)已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色。各物质的转化关系如下图(部分反应物已略去)。

请回答下列问题:
(1)E的化学式为_______________(2分)。
(2)将M丝插入盛有X溶液的试管中,反应一段时间后的现象是_______________(2分)。
(3)在反应①②③④中属于置换反应的是__________(填序号)(2分)。
(4)反应②的离子方程式为______________________________________________(2分)。
(5)用石墨作电极电解50mL X溶液,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;电解一段时间后,取出A电极,洗涤、干燥、称量,电极增重1.6g。请回答下列问题:
①写出电解时的阳极反应式________________________________________(2分)。
②电解后溶液的pH为_______________________________(3分)(假设电解前后溶液体积不变)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com