
题目列表(包括答案和解析)
I。锂——空气电池能够提供相当于普通锂离子电池10倍的能量,因此它是很有前途的电池技术。下图是锂——空气电池放电时的工作示意图。
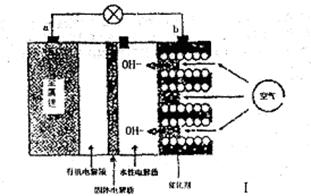
(1)图1中电极a是 极。
(2)电池中间的固体电解质(含阳离子交换膜)还能阻止H2O、N2、O2等物质的通过防止Li和这些物质反应。Li和水在常温下发生反应的化学方程式为 。
II.某些锂电池广泛应用于手机、数码相机及便携式电脑中。此种锂电池的负极通常由金属锂构成,正极由二氯亚砜(SOCl2)和碳材料构成。总反应为:4Li+2SOCl2=4LiCl+S+SO2↑,此种锂电池是一次电池,在放电时有气体产生。以下说法中正确的是 。
A.放电时电池内部Li+向负极移动[
B.放电过程中,电池负极发生氧化反应
C.放电时每移动2mol电子,有1molS被还原
D.放电时电池正极反应为:3SOCl2+4e-=SO2+S+4Cl-
III.锂电池回收具有重要意义,重点回收的正极材料,其主要成分为钴酸锂(LiCoO2)、铝箔等。
某回收工艺流程如下:
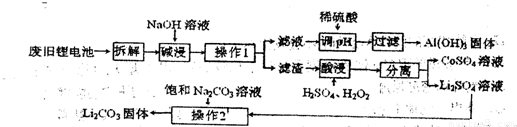
(1)废旧电池残留有单质锂,拆解时需隔绝空气,是因为锂易与空气中的 反应。
(2)酸浸时钴酸锂发生反应的化学方程式为 。若用盐酸代替H2SO4、H2O2混合液也能达到酸浸目的,但不利之处是 。
(3)Li2CO3在水中的溶解度随温度升高而减小,操作2的步骤是:加热浓缩析出晶体、 、洗涤、干燥。
I。锂——空气电池能够提供相当于普通锂离子电池10倍的能量,因此它是很有前途的电池技术。下图是锂——空气电池放电时的工作示意图。
(1)图1中电极a是 极。
(2)电池中间的固体电解质(含阳离子交换膜)还能阻止H2O、N2、O2等物质的通过防止Li和这些物质反应。Li和水在常温下发生反应的化学方程式为 。
II.某些锂电池广泛应用于手机、数码相机及便携式电脑中。此种锂电池的负极通常由金属锂构成,正极由二氯亚砜(SOCl2)和碳材料构成。总反应为:4Li+2SOCl2=4LiCl+S+SO2↑,此种锂电池是一次电池,在放电时有气体产生。以下说法中正确的是 。
A.放电时电池内部Li+向负极移动[
B.放电过程中,电池负极发生氧化反应
C.放电时每移动2mol电子,有1molS被还原
D.放电时电池正极反应为:3SOCl2+4e-=SO2+S+4Cl-
III.锂电池回收具有重要意义,重点回收的正极材料,其主要成分为钴酸锂(LiCoO2)、铝箔等。
某回收工艺流程如下:
(1)废旧电池残留有单质锂,拆解时需隔绝空气,是因为锂易与空气中的 反应。
(2)酸浸时钴酸锂发生反应的化学方程式为 。若用盐酸代替H2SO4、H2O2混合液也能达到酸浸目的,但不利之处是 。
(3)Li2CO3在水中的溶解度随温度升高而减小,操作2的步骤是:加热浓缩析出晶体、 、洗涤、干燥。
I。锂——空气电池能够提供相当于普通锂离子电池10倍的能量,因此它是很有前途的电池技术。下图是锂——空气电池放电时的工作示意图。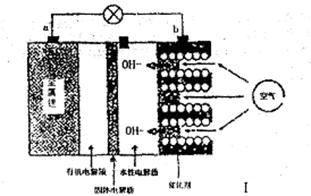
(1)图1中电极a是 极。
(2)电池中间的固体电解质(含阳离子交换膜)还能阻止H2O、N2、O2等物质的通过防止Li和这些物质反应。Li和水在常温下发生反应的化学方程式为 。
II.某些锂电池广泛应用于手机、数码相机及便携式电脑中。此种锂电池的负极通常由金属锂构成,正极由二氯亚砜(SOCl2)和碳材料构成。总反应为:4Li+2SOCl2=4LiCl+S+SO2↑,此种锂电池是一次电池,在放电时有气体产生。以下说法中正确的是 。
| A.放电时电池内部Li+向负极移动[ |
| B.放电过程中,电池负极发生氧化反应 |
| C.放电时每移动2mol电子,有1molS被还原 |
D.放电时电池正极反应为 :3SOCl2+4e-=SO2+S+4Cl- :3SOCl2+4e-=SO2+S+4Cl- |

 反应。
反应。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com