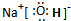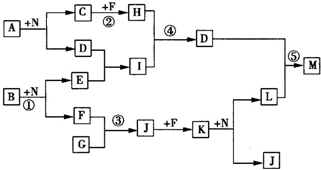
如右框图反应中所涉及的l4种物质都是由短周期元素组成的.已知:
(Ⅰ)F为单质;
(Ⅱ)A、B、C、G、H、J、K、N均是由两种元素组成的化合物,且C、G为同周期元素形成的简单气态氢化物;
(Ⅲ)D、E、I、L、M均是由3种元素组成的化合物,且D具有两性;
(Ⅳ)反应中生成的水均已略去.
请回答下列问题:
(1)写出化学式:B
Na2O2
Na2O2
,I
NaAlO2
NaAlO2
.
(2)写出E的电子式:
.
(3)反应③的化学方程式为
.
(4)解释反应⑤中生成的M的水溶液呈酸性的原因:
硝酸铝是强酸弱碱盐,铝离子水解而使其水溶液呈酸性,Al3++3H2O?Al(OH)3+3H+
硝酸铝是强酸弱碱盐,铝离子水解而使其水溶液呈酸性,Al3++3H2O?Al(OH)3+3H+
(请用化学方程式及必要的文字说明).
(5)反应②中,每1.00g C与足量的F作用,恢复到25℃时放出55.6kJ的热量,写出反应②的热化学方程式:
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6KJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6KJ/mol
;反应②在KOH作介质的环境中可形成一个原电池,则该原电池的负极反应式为
CH4-8e-+10OH-=CO32-+7H2O
CH4-8e-+10OH-=CO32-+7H2O
.

 如右框图反应中所涉及的l4种物质都是由短周期元素组成的.已知:
如右框图反应中所涉及的l4种物质都是由短周期元素组成的.已知: