
题目列表(包括答案和解析)
(1)为什么不同温度下测得的气体的摩尔质量不同呢?
(2)该无色气体的化学式怎样写?
(3)若要测定该气体的摩尔质量,最适宜的条件是什么?
(4)在
现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol
-1.若阿伏加德罗常数用NA表示,则:(1)该气体的物质的量为________
(2)该气体所含原子总数为________个.
利用“化学计量在实验中的应用”的相关知识进行填空
(3)含有6.02×1023个氧原子的H2SO4的物质的量是________
(4)与标准状况下VLCO2所含氧原子数目相同的水的质量是________
(5)在一定的温度和压强下,1体积X2(g)跟3体积Y2(g)化合生成2体积化合物,则该化合物的化学式是________
(6)三种正盐的混合溶液中含有0.2 mol Na+、0.25 mol Mg2+、0.4 mol Cl-、SO![]() ,则n(SO
,则n(SO![]() )为________
)为________
现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol
-1.若阿伏加德罗常数用NA表示,则:(1)该气体的物质的量为________
(2)该气体所含原子总数为________个.
利用“化学计量在实验中的应用”的相关知识进行填空
(3)含有6.02×1023个氧原子的H2SO4的物质的量是________
(4)与标准状况下VLCO2所含氧原子数目相同的水的质量是________
(5)在一定的温度和压强下,1体积X2 (g)跟3体积Y2 (g)化合生成2体积化合物,则该化合物的化学式是________
(6)三种正盐的混合溶液中含有0.2 mol Na+、0.25 mol Mg2+、0.4 mol Cl-、SO42-,则n(SO42-)为________
(12分).现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为______ __
(2)该气体所含原子总数为 个。
利用“化学计量在实验中的应用”的相关知识进行填空
(3)含有6.02×1023个氧原子的H2SO4的物质的量是_______
(4)与标准状况下VLCO2所含氧原子数目相同的水的质量是_____ __
(5)在一定的温度和压强下,1体积X2(g)跟3体积Y2(g)化合生成2体积化合物,则该化合物的化学式是__________ _____
(6)三种正盐的混合溶液中含有0.2 mol Na+、0 .25 mol M
.25 mol M g2+、0.4 mol Cl-、SO42—,则n(SO42—)为___ ________
g2+、0.4 mol Cl-、SO42—,则n(SO42—)为___ ________
 7N2+12H2O也可处理NO2。当转移12mol电子时,消耗的NO2在标准状况下是_________L。
7N2+12H2O也可处理NO2。当转移12mol电子时,消耗的NO2在标准状况下是_________L。 2SO3(g) ΔH=-196.6 kJ/mol
2SO3(g) ΔH=-196.6 kJ/mol  2NO2(g) ΔH=-113.0 kJ/mol
2NO2(g) ΔH=-113.0 kJ/mol  SO3(g)+NO(g)的ΔH=____________kJ/mol。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________。
SO3(g)+NO(g)的ΔH=____________kJ/mol。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________。  CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH_______0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是__________________。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH_______0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是__________________。 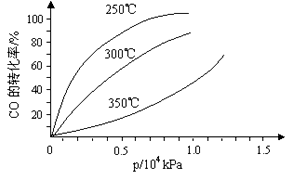
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com