
题目列表(包括答案和解析)
(12分)用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1)配制待测液:用5.00 g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000 mL溶液。除烧杯、胶头滴管、玻璃棒外,还需要的玻璃仪器有__ _。
(2)滴定:
①盛装0.1000 mol·L-1盐酸标准液应该使用_________式滴定管。
②滴定时眼睛应 。
③有关数据记录如下:
| 测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
(3)计算:烧碱样品的纯度是_________________。
(4)误差分析(选填“偏高”“偏低”或“无影响”):
①用蒸馏水冲洗锥形瓶,则会使测定结果___________;
②读数时,滴定前仰视,滴定后俯视,则会使测定结果___________。
(12分)用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1)配制待测液:用5.00 g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000 mL溶液。除烧杯、胶头滴管、玻璃棒外,还需要的玻璃仪器有__ _。
(2)滴定:
①盛装0.1000 mol·L-1盐酸标准液应该使用_________式滴定管。
②滴定时眼睛应 。
③有关数据记录如下:
|
测定序号 |
待测溶液的体积/mL |
所耗盐酸标准液的体积/mL |
|
|
滴定前 |
滴定后 |
||
|
1 |
20.00 |
0.50 |
20.78 |
|
2 |
20.00 |
1.20 |
21.32 |
(3)计算:烧碱样品的纯度是_________________。
(4)误差分析(选填“偏高”“偏低”或“无影响”):
①用蒸馏水冲洗锥形瓶,则会使测定结果___________;
②读数时,滴定前仰视,滴定后俯视,则会使测定结果___________。
摩尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂。某研究性学习小组用下图所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
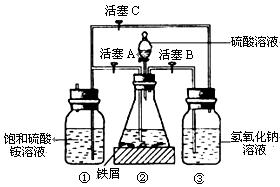
用30%的NaOH溶液和废铁屑(含少量油污、铁锈等)混合、煮沸,以除去铁屑表面油污,然后冷却、洗涤、分离,将分离出的NaOH溶液装入③中,废铁屑放入②中。
利用容器②的反应,向容器①中通入氢气,应关闭活塞 ,打开活塞 (填字母)。向容器①中通人氢气的目的是 。
待锥形瓶中的铁屑快反应完时,关闭活塞 ,打开活塞 ②中继续产生的氢气会将 (填①、②或③,后同)容器中的溶液压入① 容器,在常温下放置一段时间,混合溶液底部将结晶析出硫酸亚铁铵。
为了确定产品中亚铁离子的含量,研究小组用滴定法来测定。
①试配平反应的离子方程式:
![]()
②滴定时,将KMnO4溶液装在 (酸式或碱式)滴定管中,判断反应到达滴定终点的现象为 。
(4)装KMnO4滴定管用蒸馏水润洗后,未用KMnO4液润洗导致滴定结果(填“偏小”、“偏大”或“无影响”) 。
(5)观察装KMnO4滴定管读数时,若滴定前仰视,滴定后俯视则结果会导致测得的Fe2+溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)
(13分)摩尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂。某研究性学习小组用下图所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
(1) 用30%的NaOH溶液和废铁屑(含少量油污、铁锈等)混合、煮沸,以除去铁屑表面油污,然后冷却、洗涤、分离,将分离出的NaOH溶液装入③中,废铁屑放入②中。
(2) 利用容器②的反应,向容器①中通入氢气,应关闭活塞 ,打开活塞 (填字母)。向容器①中通人氢气的目的是 。
待锥形瓶中的铁屑快反应完时,关闭活塞 ,打开活塞 ②中继续产生的氢气会将 (填①、②或③,后同)容器中的溶液压入① 容器,在常温下放置一段时间,混合溶液底部将结晶析出硫酸亚铁铵。
(3) 为了确定产品中亚铁离子的含量,研究小组用滴定法来测定。
①试配平反应的离子方程式:
②滴定时,将KMnO4溶液装在 (酸式或碱式)滴定管中,判断反应到达滴定终点的现象为 。
(4)装KMnO4滴定管用蒸馏水润洗后,未用KMnO4液润洗导致滴定结果(填“偏小”、“偏大”或“无影响”) 。
(5)观察装KMnO4滴定管读数时,若滴定前仰视,滴定后俯视则结果会导致测得的Fe2+溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)
(13分)摩尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂。某研究性学习小组用下图所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
(1) 用30%的NaOH溶液和废铁屑(含少量油污、铁锈等)混合、煮沸,以除去铁屑表面油污,然后冷却、洗涤、分离,将分离出的NaOH溶液装入③中,废铁屑放入②中。
(2) 利用容器②的反应,向容器①中通入氢气,应关闭活塞 ,打开活塞 (填字母)。向容器①中通人氢气的目的是 。
待锥形瓶中的铁屑快反应完时,关闭活塞 ,打开活塞 ②中继续产生的氢气会将 (填①、②或③,后同)容器中的溶液压入① 容器,在常温下放置一段时间,混合溶液底部将结晶析出硫酸亚铁铵。
(3) 为了确定产品中亚铁离子的含量,研究小组用滴定法来测定。
①试配平反应的离子方程式:
②滴定时,将KMnO4溶液装在 (酸式或碱式)滴定管中,判断反应到达滴定终点的现象为 。
(4)装KMnO4滴定管用蒸馏水润洗后,未用KMnO4液润洗导致滴定结果(填“偏小”、“偏大”或“无影响”) 。
(5)观察装KMnO4滴定管读数时,若滴定前仰视,滴定后俯视则结果会导致测得的Fe2+溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com