
题目列表(包括答案和解析)
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室用无水乙醇与乙酸制备乙酸乙酯的化学方程式如下:
CH3COOH+C2H5OH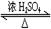 CH3COOC2H5+H2O
CH3COOC2H5+H2O
(1)该反应的平衡常数表达式K= 。
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用右图所示装置进行了以下四个实验,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验 编号 | 试管Ⅰ中的试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
| A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 饱和碳酸钠溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |

乙酸乙酯是常见酯类化合物,其实验室制备提纯过程如下:
制备反应:CH3COOH+CH3CH2OH
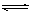 CH3COOC2H5+H20
CH3COOC2H5+H20
实验步骤:
①按照下图制备装置组装一起
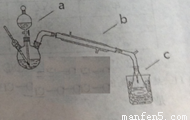
②在三颈瓶中加入4mL乙醇,慢慢振荡加入5mL浓硫酸。仪器a内装预先混合均匀的10mL乙醇和8mL乙酸
③先从a中放出3mL混合液,于石棉网上加热110-120℃.有馏分分出时,打开a活塞,控制流速(每分钟30滴)。至滴加完毕无馏分时停止加热。
④摇动盛粗产品的锥形瓶,向其中加入饱和碳酸钠溶液至有机相呈中性。
⑤将液体转入分液漏斗中,摇振后静置,弃水相。有机相依次用饱和食盐水洗涤后和饱和氯化钙溶液洗涤,每次均弃水相。
⑥有机相转入干燥的锥形瓶,加无水硫酸镁干燥。
试回答:
1、仪器a、b的名称分别为______ 、______。
2、实验步骤②加入过量的乙醇的目的是 。还需要加入______。
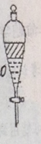
3、实验步骤5中摇荡静置后如图所示,请写出弃水相的操作 。
4、试写出实验过程中发生的副反应的方程式:乙醇被浓硫酸脱水碳化同时放出SO2: 。
5、步骤③中滴加速度过快会使乙酸乙酯的产率降低,造成产率降低的原因可能是:
①
②
乙酸乙酯是常见酯类化合物,其实验室制备提纯过程如下:
制备反应:CH3COOH+CH3CH2OH 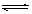 CH3COOC2H5+H20
CH3COOC2H5+H20
实验步骤:
①按照下图制备装置组装一起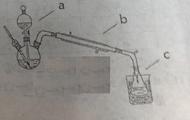
②在三颈瓶中加入4mL乙醇,慢慢振荡加入5mL浓硫酸。仪器a内装预先混合均匀的10mL乙醇和8mL乙酸
③先从a中放出3mL混合液,于石棉网上加热110-120℃.有馏分分出时,打开a活塞,控制流速(每分钟30滴)。至滴加完毕无馏分时停止加热。
④摇动盛粗产品的锥形瓶,向其中加入饱和碳酸钠溶液至有机相呈中性。
⑤将液体转入分液漏斗中,摇振后静置,弃水相。有机相依次用饱和食盐水洗涤后和饱和氯化钙溶液洗涤,每次均弃水相。
⑥有机相转入干燥的锥形瓶,加无水硫酸镁干燥。
试回答:
1、仪器a、b的名称分别为______ 、______。
2、实验步骤②加入过量的乙醇的目的是 。还需要加入______。
3、实验步骤5中摇荡静置后如图所示,请写出弃水相的操作 。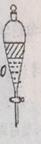
4、试写出实验过程中发生的副反应的方程式:乙醇被浓硫酸脱水碳化同时放出SO2: 。
5、步骤③中滴加速度过快会使乙酸乙酯的产率降低,造成产率降低的原因可能是:
①
②
(10分)、有机物A由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: (1)有机物A的相对分子质量为: 。 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次通过碱石灰、无水硫酸铜粉末、足量石灰水,发现碱石灰增重14.2g,硫酸铜粉末没有变蓝,石灰水中有10.0g白色沉淀生成;向增重的碱石灰中加入足量盐酸后,产生4.48L无色无味气体(标准状况)。 | (2)9.0g有机物A完全燃烧时,经计算:生成CO2共为 mol, 生成的H2O g。 有机物A的分子式 。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (4)A的结构简式 。 |
| (4)有机物A可跟乙酸发生酯化反应,其质量比为3:2;有机物A也可跟乙醇发生酯化反应,其物质的量比为1:1;且酯化反应分别发生在链中和链端。 | |
| (5)有机物A可否发生缩聚反应?若能,请直接写出反应的化学方程式;若不能,请指出原因 | |
(10分)、有机物A由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
|
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)有机物A的相对分子质量为: 。 |
|
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次通过碱石灰、无水硫酸铜粉末、足量石灰水,发现碱石灰增重14.2g,硫酸铜粉末没有变蓝,石灰水中有10.0g白色沉淀生成;向增重的碱石灰中加入足量盐酸后,产生4.48L无色无味气体(标准状况)。 |
(2)9.0g有机物A完全燃烧时,经计算:生成CO2共为 mol, 生成的H2O g。 有机物A的分子式 。 |
|
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(4)A的结构简式 。
|
|
(4)有机物A可跟乙酸发生酯化反应,其质量比为3:2;有机物A也可跟乙醇发生酯化反应,其物质的量比为1:1;且酯化反应分别发生在链中和链端。 |
|
|
(5)有机物A可否发生缩聚反应?若能,请直接写出反应的化学方程式;若不能,请指出原因 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com