
题目列表(包括答案和解析)
 卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.
卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义. WI2(g).为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL
WI2(g).为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL
卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义。
(1)近年来,各地报刊纷纷转载了不要将不同品牌洁污剂混合使用的警告。据报道,在全国各地发生了多起混合洁污剂发生氯气中毒的事件。根据你的化学知识作出如下判断:
当事人使用的液态洁污剂之一必定含氯,最可能的存在形式是 和 。当另一种具有 (性质)的液态洁污剂与之混合,可能发生如下反应而产生氯气:
。
(2)次氯酸盐的氧化性较强,可在碱性环境中将许多物质氧化,例如可用其将Fe3+氧化为新型杀菌消毒剂FeO42-,写出该反应的离子方程式 。
(3)碘钨灯具有比白炽灯寿命长且环保节能的特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:
W(s)+I2(g)![]() WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中, 加热使其反应。
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中, 加热使其反应。
如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。ks*5*u
|
|
|
|

则:①该反应的△H 0(填“>” 或“=”或“<”)
②从反应开始到t1时间内的平均反应速率v(I2)= 。
③下列说法中不正确的是 (填序号)。
A.该反应的平衡常数表达式是![]()
B.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
C.利用该反应原理可以提纯钨
(4)25℃时,向5mL含有KCl和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液后,溶液中离子浓度由大到小的顺序是 。
[不考虑H+和OH-。25℃时KSP(AgCl)=1.8×10-10、KSP(AgI)=8.3×10-17]。
(5)Mg常用作提纯Ti的试剂,已知:
①Mg(s)+Cl2(g)=MgCl2(s) △H= —641kJ/mol ②Ti(s)+2Cl2(g)=TiCl4(l) △H= —770kJ/mol
请写出Mg与液态TiCl4反应提纯钛的热化学方程式 。
卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义。
(1)近年来,各地报刊纷纷转载了不要将不同品牌洁污剂混合使用的警告。据报道,在全国各地发生了多起混合洁污剂发生氯气中毒的事件。根据你的化学知识作出如下判断:
当事人使用的液态洁污剂之一必定含氯,最可能的存在形式是 和 。当另一种具有 (性质)的液态洁污剂与之混合,可能发生如下反应而产生氯气:
。
(2)次氯酸盐的氧化性较强,可在碱性环境中将许多物质氧化,例如可用其将Fe3+氧化为新型杀菌消毒剂FeO42-,写出该反应的离子方程式 。
(3)碘钨灯具有比白炽灯寿命长且环保节能的特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:
W(s)+I2(g)![]() WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中, 加热使其反应。
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中, 加热使其反应。
如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。
|
|
|
|
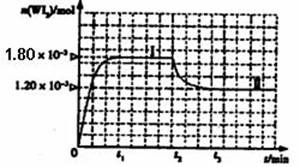
则:①该反应的△H 0(填“>” 或“=”或“<”)
②从反应开始到t1时间内的平均反应速率v(I2)= 。
③下列说法中不正确的是 (填序号)。
A.该反应的平衡常数表达式是![]()
B.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
C.利用该反应原理可以提纯钨
(4)25℃时,向5mL含有KCl和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液后,溶液中离子浓度由大到小的顺序是 。
[不考虑H+和OH-。25℃时KSP(AgCl)=1.8×10-10、KSP(AgI)=8.3×10-17]。
(5)Mg常用作提纯Ti的试剂,已知:
①Mg(s)+Cl2(g)=MgCl2(s) △H= —641kJ/mol ②Ti(s)+2Cl2(g)=TiCl4(l) △H= —770kJ/mol
请写出Mg与液态TiCl4反应提纯钛的热化学方程式 。
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0 ,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)= 。平衡时H2的转化率为 %。
2NH3(g) ΔH<0 ,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)= 。平衡时H2的转化率为 %。
(2)平衡后,若提高H2的转化率,可以采取的措施有 。
A.加了催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量N2
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:
N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
T/ ℃ | 200 | 300 | 400 |
k | K1 | K2 | 0.5 |
请完成下列问题:
① 试比较K1 、K2的大小,K1_______ K2 (填“<”“>”或“=”);
② 下列各项能作为判断该反应达到化学平衡状态的依据是________(填序号字母)
A、容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B、v(N2)正=3 v(H2)逆
C、容器内压强保持不变
D、混合气体的密度保持不变
③400℃时,反应2NH3(g) ![]() N2(g)+3H2(g)的化学平衡常数为_______。当测得NH3、N2和H2的物质的量分别为3mol、2 mol和1 mol时,则该反应的
N2(g)+3H2(g)的化学平衡常数为_______。当测得NH3、N2和H2的物质的量分别为3mol、2 mol和1 mol时,则该反应的
v(N2)正______v(N2) 逆 (填“<”“>”或“=”)。
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是_________。
A、化学反应速率理论可指导怎样在一定时间内快出产品
B、勒夏特列原理可指导怎样使用有限原料多出产品
C、催化剂的使用是提高产品产率的有效方法
D、正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益
 2PbSO4(s) +2H2O(l)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________(填写序号)。
2PbSO4(s) +2H2O(l)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________(填写序号)。 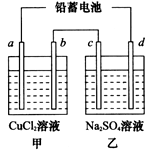
 H++A2-。
H++A2-。  CH3OH(g) △H=-90.8kJ/mol
CH3OH(g) △H=-90.8kJ/mol  CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol  CO2(g)+H2(g) △H=-41.3kJ/mol
CO2(g)+H2(g) △H=-41.3kJ/mol  2SO3(g)。在一定温度下,将0.23molSO2和0.11molO2通入容积为1L的密闭容器中发生反应,达到平衡后得到0.12molSO3,则反应的平衡常数K=__________。若温度不变,再通入0.50molO2后重新达到平衡,则SO3的体积分数将__________(填“增大”“不变”或“减小”)。
2SO3(g)。在一定温度下,将0.23molSO2和0.11molO2通入容积为1L的密闭容器中发生反应,达到平衡后得到0.12molSO3,则反应的平衡常数K=__________。若温度不变,再通入0.50molO2后重新达到平衡,则SO3的体积分数将__________(填“增大”“不变”或“减小”)。 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com