
题目列表(包括答案和解析)
(16分)亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示。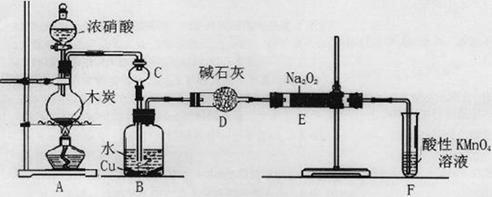
已知:室温下,① 2NO+Na2O2=2NaNO2;②酸性条件下,NO或NO2—都能与MnO4—反应生成NO3—和Mn2+,5NO2— + 2MnO4—+ 6H+=5NO3—+ 2Mn2++ 3H2O。
(1)A中观察到的现象__________________________。
(2)装置B中反应的离子方程式有____________________,_____________________。
(3)装置C的作用:____________________,装置F的作用:___________________。
(4)若无装置D,则E中产物除亚硝酸钠外还含有副产物________________________。(填化学式)
(5)NaNO2有像食盐一样的咸味,但能引起中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O,根据上述反应,可以用试剂和生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐。进行实验时,必须选用的物质有__________________。
| A.自来水 | B.碘化钾淀粉试液 | C.淀粉 | D.白糖 E.食醋 F.白酒 |
“氢能”将是未来最理想的新能源。
Ⅰ.实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为_______。(填序号)
A.2H2(g)+O2(g)  2H2O(l)
△H= -142.9kJ·mol—1
2H2O(l)
△H= -142.9kJ·mol—1
B.H2(g)+1/2 O2(g)  H2O(l)
△H= -285.8kJ·mol—1
H2O(l)
△H= -285.8kJ·mol—1
C.2H2+O2 2H2O(l)
△H= -571.6kJ·mol—1
2H2O(l)
△H= -571.6kJ·mol—1
D.H2(g)+1/2
O2(g)  H2O(g) △H= -285.8kJ·mol—1
H2O(g) △H= -285.8kJ·mol—1
Ⅱ.某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤
①CaBr2+H2O CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg HgBr2+H2
HgBr2+H2
③HgBr2+_____ ______________
④2HgO
______________
④2HgO 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:____________。
根据“绿色化学”的思想评估该方法制H2的主要缺点:______________。
Ⅲ.利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。(提示:反应②的产物是O2、SO2和H2O)

完成下列反应的化学方程式:
反应①__________________________;反应②__________________________。
此法制取氢气的最大优点是_______________________________________________。
Ⅳ.氢气通常用生产水煤气的方法制得。其中CO(g)+ H2O(g) 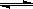 CO2(g)+ H2(g); △H<0。
CO2(g)+ H2(g); △H<0。
在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K______1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、1.0mol CO2 和 x mol H2,则:
①当x=5.0时,上述平衡向___________(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是__________。
(3)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a _______ b(填“大于”、“小于”或“等于”)。
Ⅴ.氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。
(1)现有8克氧化铜被氢气还原后,得到红色固体6.8克,其中含单质铜与氧化亚铜的物质的量之比是 ;
(2)若将6.8克上述混合物与足量的稀硫酸充分反应后过滤,可得到固体 g;
(3)若将6.8克上述混合物与一定量的浓硝酸充分反应,
①生成标准状况下1.568升的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是 ,其物质的量之比是 ;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤,得晶体23.68g。经分析,原溶液中的Cu2+有20%残留在母液中。求所得晶体的化学式
NO的生物活性已引起科学家高度重视。它与超氧离子(O2— )反应,该反应的产物本题用A为代号。在生理pH值条件下,A的半衰期为1-2秒。A被认为是人生病,如炎症、中风、心脏病和风湿病等引起大量细胞和组织毁坏的原因。A在巨噬细胞里受控生成却是巨噬细胞能够杀死癌细胞和入侵的微生物的重要原因。科学家用生物拟态法探究了A的基本性质,如它与硝酸根的异构化反应等。他们发现,当16O标记的A在18O标记的水中异构化得到的硝酸根有11% 18O,可见该反应历程复杂。回答如下问题:(1)写出A的化学式。写出NO跟超氧离子的反应。这你认为A离子的可能结构是什么?试写出它的路易斯结构式(即用短横表示化学键和用小黑点表示未成键电子的结构式)。(2)A离子和水中的CO2迅速一对一地结合。试写出这种物种可能的路易斯结构式。(3)含Cu+离子的酶的活化中心,亚硝酸根转化为一氧化氮。写出Cu+和NO2–在水溶液中的反应。(4)在常温下把NO气体压缩到100个大气压,在一个体积固定的容器里加热到50oC,发现气体的压力迅速下降,压力降至略小于原压力的2/3就不再改变,已知其中一种产物是N2O,写出化学方程式。并解释为什么最后的气体总压力略小于原压力的2/3。
“氢能”将是未来最理想的新能源.
Ⅰ.实验测得,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为________.(填序号)
A.
2H2(g)+O2(g)B.H2(g)+1/2O2(g)![]() H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
C.2H2+O2![]() 2H2O(l) ΔH=-571.6 kJ·mol-1
2H2O(l) ΔH=-571.6 kJ·mol-1
D.H2(g)+1/2O2(g)![]() H2O(g) ΔH=-285.8 kJ·mol-1
H2O(g) ΔH=-285.8 kJ·mol-1
Ⅱ
.某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤①CaBr2+H2O CaO+2HBr
CaO+2HBr
②2HBr+Hg HgBr2+H2
HgBr2+H2
③HgBr2+________ ________
________
④2HgO 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:________.
根据“
绿色化学”的思想评估该方法制H2的主要缺点:________.Ⅲ
.利用核能把水分解制氢气,是目前正在研究的课题.下图是其中的一种流程,其中用了过量的碘.(提示:反应②的产物是O2、SO2和H2O)
完成下列
反应的化学方程式:反应①________;反应②________.
此法制取
氢气的最大优点是________.Ⅳ
.氢气通常用生产水煤气的方法制得.其中CO(g)+H2O(g)(1)若升高温度到950℃时,达到平衡时K________1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向________(填正反应或逆反应)方向进行.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________.
(3)在850℃时,若设x=5.0 mol和x=6.0 mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a________b(填“大于”、“小于”或“等于”).
Ⅴ
.氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜.(1)现有8克氧化铜被氢气还原后,得到红色固体6.8克,其中含单质铜与氧化亚铜的物质的量之比是________;
(2)若将6.8克上述混合物与足量的稀硫酸充分反应后过滤,可得到固体________g;
(3)若将6.8克上述混合物与一定量的浓硝酸充分反应,
①生成标准状况下1.568升的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是________,其物质的量之比是________;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤,得晶体23.68 g.经分析,原溶液中的Cu2+有20%残留在母液中.求所得晶体的化学式
(12分) NO的生物活性已引起科学家高度重视。它与超氧离子(O2― )反应,该反应的产物本题用A为代号。在生理pH值条件下,A的半衰期为1-2秒。A被认为是人生病,如炎症、中风、心脏病和风湿病等引起大量细胞和组织毁坏的原因。A在巨噬细胞里受控生成却是巨噬细胞能够杀死癌细胞和入侵的微生物的重要原因。科学家用生物拟态法探究了A的基本性质,如它与硝酸根的异构化反应等。他们发现,当16O标记的A在18O标记的水中异构化得到的硝酸根有11% 18O,可见该反应历程复杂。回答如下问题:(1)写出A的化学式。写出NO跟超氧离子的反应。这你认为A离子的可能结构是什么?试写出它的路易斯结构式(即用短横表示化学键和用小黑点表示未成键电子的结构式)。(2)A离子和水中的CO2迅速一对一地结合。试写出这种物种可能的路易斯结构式。(3)含Cu+离子的酶的活化中心,亚硝酸根转化为一氧化氮。写出Cu+和NO2在水溶液中的反应。(4)在常温下把NO气体压缩到100个大气压,在一个体积固定的容器里加热到50oC,发现气体的压力迅速下降,压力降至略小于原压力的2/3就不再改变,已知其中一种产物是N2O,写出化学方程式。并解释为什么最后的气体总压力略小于原压力的2/3。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com