
题目列表(包括答案和解析)
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.乙炔是有机合成工业的一种原料。工业上曾用![]() 与水反应生成乙炔。
与水反应生成乙炔。
(1) ![]() 中
中![]() 与
与![]() 互为等电子体,
互为等电子体,![]() 的电子式可表示为 ;1mol
的电子式可表示为 ;1mol ![]() 中含有的
中含有的![]() 键数目为 。
键数目为 。
(2)将乙炔通入 溶液生成
溶液生成 红棕色沉淀。
红棕色沉淀。 基态核外电子排布式为 。
基态核外电子排布式为 。
 (3)乙炔与氢氰酸反应可得丙烯腈
(3)乙炔与氢氰酸反应可得丙烯腈![]() 。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
(4) ![]() 晶体的晶胞结构与
晶体的晶胞结构与![]() 晶体的相似(如右图所示),但
晶体的相似(如右图所示),但![]() 晶体中含有的中哑铃形
晶体中含有的中哑铃形![]() 的存在,使晶胞沿一个方向拉长。
的存在,使晶胞沿一个方向拉长。![]() 晶体中1个
晶体中1个![]() 周围距离最近的
周围距离最近的![]() 数目为 。
数目为 。
B.对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。

一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在![]() 溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(l)上述实验中过滤的目的是 。
(2) 滤液在分液漏斗中洗涤静置后,有机层处于 层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有 。
(3) 下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
| 催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
| n(甲苯) | 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | ||
| 浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
| 1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
| NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
| 0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
| 0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
| 0.36 | 45.2 | 54.2 | 0.6 | 99.9 |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为 。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是 。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有_ 、 。
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.乙炔是有机合成工业的一种原料。工业上曾用 与水反应生成乙炔。
与水反应生成乙炔。
(1)  中
中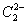 与
与 互为等电子体,
互为等电子体, 的电子式可表示为 ;1mol
的电子式可表示为 ;1mol  中含有的
中含有的 键数目为 。
键数目为 。
(2)将乙炔通入 溶液生成
溶液生成 红棕色沉淀。
红棕色沉淀。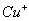 基态核外电子排布式为
。
基态核外电子排布式为
。
 (3)乙炔与氢氰酸反应可得丙烯腈
(3)乙炔与氢氰酸反应可得丙烯腈 。丙烯腈分子中碳原子轨道杂化类型是
;分子中处于同一直线上的原子数目最多为
。
。丙烯腈分子中碳原子轨道杂化类型是
;分子中处于同一直线上的原子数目最多为
。
(4)  晶体的晶胞结构与
晶体的晶胞结构与 晶体的相似(如右图所示),但
晶体的相似(如右图所示),但 晶体中含有的中哑铃形
晶体中含有的中哑铃形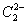 的存在,使晶胞沿一个方向拉长。
的存在,使晶胞沿一个方向拉长。 晶体中1个
晶体中1个 周围距离最近的
周围距离最近的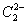 数目为
。
数目为
。
B.对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。

一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在 溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(l)上述实验中过滤的目的是 。
(2) 滤液在分液漏斗中洗涤静置后,有机层处于 层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有 。
(3) 下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
|
催化剂 |
n(催化剂) |
硝化产物中各种异构体质量分数(%) |
总产率(%) |
||
|
n(甲苯) |
对硝基甲苯 |
邻硝基甲苯 |
间硝基甲苯 |
||
|
浓H2SO4 |
1.0 |
35.6 |
60.2 |
4.2 |
98.0 |
|
1.2 |
36.5 |
59.5 |
4.0 |
99.8 |
|
|
NaHSO4 |
0.15 |
44.6 |
55.1 |
0.3 |
98.9 |
|
0.25 |
46.3 |
52.8 |
0.9 |
99.9 |
|
|
0.32 |
47.9 |
51.8 |
0.3 |
99.9 |
|
|
0.36 |
45.2 |
54.2 |
0.6 |
99.9 |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为 。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是 。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有_ 、 。
(15分)硫酸铜在化工和农业方面有很广泛的用处,某化学兴趣小组查阅资料,用两种不同的原料制取硫酸铜。
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O(含有SiO2、FeCO3、Fe2O3、Al2O3等杂质)。以这种矿石为原料制取硫酸铜的工艺流程如下图:
请回答下列问题:
⑴完成步骤①中稀硫酸与CuSiO3·2H2O发生反应的化学方程式
CuSiO3·2H2O+H2SO4=CuSO4 +________+H2O;
⑵步骤②调节溶液pH选用的最佳试剂是__________________
A. CuO B. MgO C. FeCO3 D NH3·H2O
⑶有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |

 R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
① 实验2条件下平衡常数K=??????? ??? 。
② 实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值_______(填具体值或取值范围)。
③ 实验4,若900℃时,在此容器中加入CO、H2O、CO2 、H2均为1mol,则此时V正???? V逆(填“<” ,“>” ,“=”)。
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)?? ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g)?? ΔH=-566.0 kJ/mol
③H2O(g) = H2O(l)?? ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系??????????????? ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为??????? _______________mol/L。
(5)以二甲醚(CH3OCH3)、空气、H2SO4为原料,铂为电极可构成燃料电池,其工作原理与甲烷燃料电池的原理相似。请写出该电池负极上的电极反应式:????????? 。
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)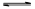 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com