
题目列表(包括答案和解析)
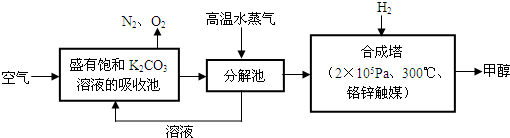
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如右图所示。
①合成氨条件选定的主要原因是(选填字母序号) ;
A.温度、压强对化学反应速率及化学平衡影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
②改变反应条件,平衡会发生移动。压强增大,平衡常数K (填“增大”“减小”“不变”)
(2)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B两种物质。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3molA。
①写出氨气和氟气反应的化学方程式 ;
②在标准状况下,每生成1 mol B,转移电子的数目为 。
(3) 最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。它既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,加入强碱溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2═2N2+6H2O。写出负极电极反应式 。
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如右图所示。
①合成氨条件选定的主要原因是(选填字母序号) ;
A.温度、压强对化学反应速率及化学平衡影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
②改变反应条件,平衡会发生移动。压强增大,平衡常数K (填“增大”“减小”“不变”)
(2)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B两种物质。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3molA。
①写出氨气和氟气反应的化学方程式 ;
②在标准状况下,每生成1 mol B,转移电子的数目为 。
(3) 最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。它既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,加入强碱溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2═2N2+6H2O。写出负极电极反应式 。
(16分)某城市的管道煤气是水煤气和焦炉煤气混合而成的,但煤气泄露能致人中毒。煤气中毒就是CO中毒,其原因是CO与血红蛋白(Hb)结合成Hb·CO,使血红蛋白失去输送O2功能的缘故。CO进入血液后有如下平衡:CO+Hb·O2![]() O2+Hb·CO,已知该反应平衡时,
O2+Hb·CO,已知该反应平衡时,![]() 的比值是一个不受浓度影响的常数,在人体体温37℃下,该常数为220。试回答:
的比值是一个不受浓度影响的常数,在人体体温37℃下,该常数为220。试回答:
(1)水煤气的主要成分是 ,生产原料为 。
(2)燃气灶具因燃气成分、供气压力不同而结构不同。如果该城市管道气改通液化石油气(C4H10),则居民厨房中的炉灶改装时在燃气进口直径不变的情况下,通风口直径应怎样改 变? (增大或减小),原因是
(3)门窗紧闭的厨房内一旦发生煤气大量泄漏,极容易发生爆炸。当你从室外进入厨房嗅到极浓的煤气异味时,在下列操作中,你认为合适的是 (可以多选)
A 立即开启抽油烟机排出煤气,关闭煤气源
B 立即打开门和窗,关闭煤气源 C 立即打开电灯,寻找泄漏处
(4)煤气中毒病人,可以通过进入高压氧舱的方法来救治,请用化学平衡的原理加以说明:
(5)已知当血液中![]() 的比值大于0.02时,人的智力会受到损伤,此时c(CO)与c(O2)的比值应 9.09×10-5(<、>或=),才不至于智力受损。抽烟时,进入肺部的空气中c(CO)=10-6mol/L,c(O2)=10-2mol/L,则c(Hb·CO)
的比值大于0.02时,人的智力会受到损伤,此时c(CO)与c(O2)的比值应 9.09×10-5(<、>或=),才不至于智力受损。抽烟时,进入肺部的空气中c(CO)=10-6mol/L,c(O2)=10-2mol/L,则c(Hb·CO)
为c(H·O2)的0.022倍,因此长期抽烟对人智力 影响。(有或无)
汽车尾气污染已成为一重大公害.汽车内燃机中,汽油气化后与空气按一定比例混合进入气缸,引擎用电火花引燃,此时气缸内温度迅速升高,气体体积急剧膨胀,产生压力推动活塞,燃烧时产生的有害气体通过尾气排出污染大气.假设汽油的成分全部为辛烷(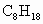 ),并设空气中
),并设空气中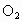 体积占五分之一,其余为
体积占五分之一,其余为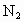 ,试讨论分析以下问题:
,试讨论分析以下问题:
(1)设辛烷气体与空气在相同状况下的体积比为a,要使辛烷完全燃烧,a的最大值为_____________.
(2)若辛烷与空气的体积比大于a时,则尾气所含污染大气的有害气体中相对含量会增多的是____________(写化学式);当产生污染气体的物质的量为xmol时,反应的化学方程式是______________.
(3)近年来,我国部分城市开始使用天然气作为汽车燃料,其主要目的是
[ ]
A.防止石油短缺
B.加大发动机动力
C.避免污染
D.降低成本
(4)改用天然气后应________(填“调大”或“调小”)燃料与空气的体积比.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com