
题目列表(包括答案和解析)



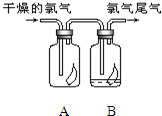 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是下列叙述中正确的是( )
A.氯气的性质很活泼,它与氢气混合后立即发生爆炸
B.漂白粉是一种混合物,它的有效成分是氯化钙和次氯酸
C.漂白液和漂白粉的成分完全相同
D.氯水经光照后有气泡逸出,若将该气体收集起来,它能使带火星的木条复燃
A.氯气的性质很活泼,它与氢气混合后立即发生爆炸
B.漂白粉是一种混合物,它的有效成分是氯化钙和次氯酸
C.漂白液和漂白粉的成分完全相同
D.氯水经光照后有气泡逸出,若将该气体收集起来,它能使带火星的木条复燃
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com