
题目列表(包括答案和解析)
右图为20mL未知浓度的盐酸用一标准浓度NaOH溶液滴定时的滴定曲线。则两种溶液的物质的量浓度分别是:
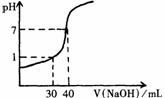
[HCl]= ,[NaOH]= 。
(1)右图Ⅰ表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL, 如果刻度A为4,量筒中液体的体积是________mL。
(2)右图II表示50mL滴定管中液面的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)______________。
A. 是amL B.是(50-a)mL
C. 一定大于amL D.一定大于(50-a)mL
(3)右图Ⅲ为20mL未知浓度的盐酸用一标准浓度NaOH溶液滴定时的滴定曲线。则两种溶液的物质的量浓度分别是:
[HCl]= ,[NaOH]= 。
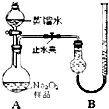 (2011?宁德一模)某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究.
(2011?宁德一模)某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究.| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 标准盐酸体积(mL) | 23.00 | 24.98 | 25.00 | 25.02 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com