
题目列表(包括答案和解析)
(1)求HxA的相对分子质量。
(2)根据上述数据推断,一个HxA分子中含有几个氢原子?
(3)A的相对原子质量是____________,A原子核中含有____________个中子。
(4)A原子的核外电子排布式是____________。
(5)A元素在周期表中的位置为第____________周期、第____________族,元素符号是____________。
(6)A的最高化合价为____________,最低化合价为____________。
(7)写出HxA分子的电子式:____________。
(8)H—A键是____________键,HxA是____________分子。(填“极性”或“非极性”)
(11分)根据提供条件推断元素,并按要求填空:
1.原子核外有3个电子层,其最外层电子数为7,最高价氧化物化学式 ________ ,最高价氧化物对应水化物化学式 ________ ,其最高价氧化物对应水化物与NaOH反应的化学方程式为 ___________________________。
2.第3周期元素,其最外层电子数与电子层数相同。该元素最高价氧化物的化学式为______________,最高价氧化物对应水化物与氢氧化钠反应的化学方程式为_______________。
3.原子序数依次递增的同周期四种元素,它们氢化物的质子数与电子数都与Ar相同,这些氢化物的化学式分别为 _______ 、 ________ 、 ________ 、 ________ 。
4.某元素的最高正价与最低负价的代数和为4,且最高价氧化物中含氧质量分数为60%。则该元素最高价氧化物的化学式为 ________ 。
(11分)
根据信息回答下列问题:
(1) 上表中实线是元素周期表的部分边界,请你用实线标出表的上边界,并把符合下列要求的元素的元素符号标在表中对应位置处。
① 最高价氧化物的水化物碱性最强(放射性元素除外)。
② 电负性最大。
③ 第一电离能对大。
(2)F元素的原子核外有25个运动状态不同的电子,F元素是 (名称),F2+的未成对电子数是_____ ,与F之具有相同最高正价的另一同周期元素的单质在常温下的状态为 。(填固态、液态、气态)
(3)列举一种由A、C、E、G四种元素组成的盐 。
(4)D的最高价氧化物对应的水化物属两性化合物,证明这一结论的有关离子方程式为_______________________________、_____________________________
(5)元素M基态原子中次外层有5个未成对电子而最外层只有一个电子; MCl3能与B和C的氢化物共同形成配位数为6的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。MCl3形成的配合物的化学式为_____ ___(用具体元素符号表示)。
根据所学知识,完成下列问题:
(1)化学反应可视为旧键断裂和新键生成的过程。键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和其燃烧产物P4O6的分子结构如图所示,现提供以下键能(kJ· mol-1): P-P:198, P-O:360, O-O:498,白磷(P4)燃烧的热化学方程式为 。
(2)化学能与电能之间可以相互转化,以Fe、Cu、C(石墨)、CuSO4溶液、FeSO4溶液、Fe2(SO4)3溶液 、AgNO3溶液为原料,通过原电池反应实现2Fe3+ + Cu=2Fe2+ + Cu2+,请你把下图补充完整,使之形成闭合回路,并用元素符号标明电极。甲池中电解液是 溶液;乙池中电解液是 溶液。(要求:甲、乙两池中电解质元素种类始终保持不变)
(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
①对PM2.5空气样本用蒸馏水处理,制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/ mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
 2NO(g)
2NO(g) 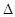 H>0
H>0根据所学知识,完成下列问题:
(1)化学反应可视为旧键断裂和新键生成的过程。键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和其燃烧产物P4O6的分子结构如图所示,现提供以下键能(kJ· mol-1): P-P:198, P-O:360, O-O:498,白磷(P4)燃烧的热化学方程式为 。

(2)化学能与电能之间可以相互转化,以Fe、Cu、C(石墨)、CuSO4溶液、FeSO4溶液、Fe2(SO4)3溶液 、AgNO3溶液为原料,通过原电池反应实现2Fe3+ + Cu=2Fe2+ + Cu2+,请你把下图补充完整,使之形成闭合回路,并用元素符号标明电极。甲池中电解液是 溶液;乙池中电解液是 溶液。(要求:甲、乙两池中电解质元素种类始终保持不变)

(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
①对PM2.5空气样本用蒸馏水处理,制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
|
离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
|
浓度/ mol?L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断该试样的酸碱性为 ,试样的pH值=
②已知气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g)
2NO(g)  H>0
H>0
若1 mol空气含有0.8 molN2和0.2 molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8 × 10-4 mol.计算该温度下的平衡常数K= ___________;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com