
题目列表(包括答案和解析)
酯是重要的有机合成中间体,请回答下列问题:
(1)实验室制取乙酸乙酯的实验中,烧瓶中除加入乙醇、浓硫酸和无水乙酸外,还应放入碎瓷片,其目的是 。烧瓶中发生的反应的化学方程式为 。
(2)欲提高乙酸的转化率,可采取的措施有 、 等。 (3)锥形瓶内收集的乙酸乙酯粗产品中所含杂质
(3)锥形瓶内收集的乙酸乙酯粗产品中所含杂质
主要有 。
(4)实验时可观察到锥形瓶中有气泡产生,
用离子方程式表示产生气泡的原因: 。
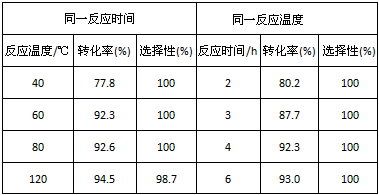
(5)此反应以浓硫酸作为催化剂,可能会造成产生大量酸性废液,催化剂重复使用困难等问题。现代研究表明质子酸离子液体可作此反应的催化剂,实验数据如下表所示(乙酸和乙醇以等物质的量混合):
| 同一反应时间 | 同一反应温度 | ||||
| 反应温度/℃ | 转化率(%) | 选择性(%) | 反应时间/h | 转化率(%) | 选择性(%) |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.7 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| A.120℃,4h | B.80℃,2h | C.60℃,4h | D.40℃,3h |

酯是重要的有机合成中间体,请回答下列问题:
(1)实验室制取乙酸乙酯的实验中,烧瓶中除加入乙醇、浓硫酸和无水乙酸外,还应放入碎瓷片,其目的是 。烧瓶中发生的反应的化学方程式为 。
(2)欲提高乙酸的转化率,可采取的措施有 、 等。
 (3)锥形瓶内收集的乙酸乙酯粗产品中所含杂质
(3)锥形瓶内收集的乙酸乙酯粗产品中所含杂质
主要有 。
(4)实验时可观察到锥形瓶中有气泡产生,
用离子方程式表示产生气泡的原因: 。
(5)此反应以浓硫酸作为催化剂,可能会造成产生大量酸性废液,催化剂重复使用困难等问题。现代研究表明质子酸离子液体可作此反应的催化剂,实验数据如下表所示(乙酸和乙醇以等物质的量混合):
| 同一反应时间 | 同一反应温度 | ||||
| 反应温度/℃ | 转化率(%) | 选择性(%) | 反应时间/h | 转化率(%) | 选择性(%) |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.7 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
(说明:选择性100%表示反应生成的产物是乙酸乙酯和水)
根据表中数据,下列_________(填编号),为该反应的最佳条件。
A. 120℃,4h B. 80℃,2h C. 60℃,4h D. 40℃,3h
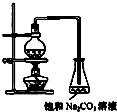 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH | 浓硫酸 | △ |
| 物质 | 室温下色、态 | 密度(g/ml) | 熔点(℃) | 沸点(℃) |
| 苯甲酸 | 白色固体 | 1.2659 | 122 | 249 |
| 甲醇 | 无色液体 | 0.7915 | -97.8 | 64.65 |
| 苯甲酸甲酯 | 无色液体 | 1.0888 | -12.3 | 199.6 |
| 乙酸 | 无色液体 | \ | 16.6 | 117.9 |
| 乙醇 | 无色液体 | \ | -117.3 | 78.5 |
| 乙酸乙酯 | 无色液体 | \ | 83.6 | 77.1 |

| 浓H2SO4 |
| △ |


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com