
题目列表(包括答案和解析)
 (2010?烟台一模)硫酸工厂周围的空气中有较多的二氧化硫.某研究性学习小组为了测定空气
(2010?烟台一模)硫酸工厂周围的空气中有较多的二氧化硫.某研究性学习小组为了测定空气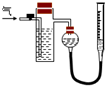
硫酸工厂周围的空气中有较多的二氧化硫。某研究性学习小组为了测定空气中二氧化硫的体积分数设计了如下两个方案:
方案一:取标准状态下的空气V L(内含N2、O2、CO2、SO2等),缓慢通过足量溴水,在所得的溶液中加入过量的氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
请回答:
(1)加入过量的氯化钡溶液的目的是 。
(2)过滤后,若在滤液中加入硫酸钠溶液,有白色沉淀产生,说明
。
(3)过滤后,一般要用蒸馏水洗涤沉淀2—3次,以除去附在沉淀上的可溶性物质。请说明应通过什么方法验证可溶物质是否已被除尽(要求:实验过程、使用的试剂、现象及结论)
。

 方案二:如右图所示,装置中反应管内装有碘的淀粉溶液。按设计意图,将空气(内含N2、O2、CO2、SO2等)通过此装置时,其中的SO2被吸收,量气管内增加的体积为其余气体的体积。
方案二:如右图所示,装置中反应管内装有碘的淀粉溶液。按设计意图,将空气(内含N2、O2、CO2、SO2等)通过此装置时,其中的SO2被吸收,量气管内增加的体积为其余气体的体积。
(4)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2的含量 (选填“偏高”、“偏低”或“不受影响”)。
(5)反应管内碘的淀粉溶液可以用下列 (填代号)代替。
A.NaOH溶液 B.酸性KMnO4溶液 C.Na2SO3溶液 D.BaCl2溶液
(6)研究小组经过讨论发现方案二的设计中有一个明显的缺陷影响了测定
结果(不属于操作错误),你认为该缺陷是
。
硫酸工厂周围的空气中有较多的二氧化硫。某研究学习小组为了测定空气中二氧化硫的体积分数设计了如下两个方案:
方案一:取标准状态下的空气V L(内含N2、O2、CO2、SO2等),缓慢通过足量溴水,在所得的溶液中加入过量的氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g.请回答:
(1)加入过量的氯化钡溶液的目的是____________________________________。
(2)过滤后,若在滤液中加入硫酸钠溶液,有白色沉淀产生,说明_______________________.
(3)过滤后,一般要用蒸馏水洗涤沉淀2―3次,以除去附在沉淀上的可溶性物质。请说明应通过什么方法验证可溶物质是否已被除尽(要求:实验过程、使用的试剂、现象及结论)。
______________________________________________________________________________________________________________________________________________________________
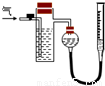
方案二:采用如右图所示装置,装置中反应管内装有碘的淀粉溶液。按设计意图,将空气(内含N2、O2、CO2、SO2等)通过此装置时,其中的SO2被吸收,量气管内增加的体积为其余气体的体积。

(4)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2的含量__________(选填“偏高”“偏低”或“不受影响:)。
(5)反应管内的碘的淀粉溶液可以用下列的_____________(填代号)代替:
A.NaOH溶液 B.酸性KMnO4溶液 C.Na2SO3溶液 D.BaCl2溶液
(6)若碘溶液体积为VamL ,浓度为c mol?L-1。剩余气体的体积为VbmL(已折算成标准状态下的体积)。用c、Va、Vb表示SO2的体积分数为:___________________
(7)研究小组经过讨论发现方案二的设计中有一个明显的缺陷影响了测定结果(不属于操作错误),你认为是__________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com