(2011?香坊区二模)某校化学活动小组的同学欲用氧化铜、铁粉和稀硫酸为原料制备金属铜.
[设计与实验]实验过程和相应的现象如图所示:
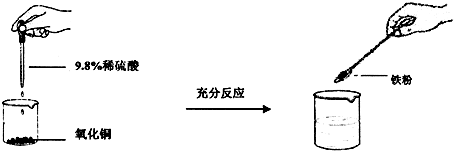
|
学生甲 |
学生乙 |
学生丙 |
| 氧化铜的质量(g) |
8 |
8 |
8 |
| 9.8%稀硫酸的质量(g) |
50 |
100 |
150 |
| 铁粉的质量(g) |
5.6 |
5.6 |
5.6 |
| 加入铁粉后的现象 |
有红色和黑色固体 |
有红色固体 |
有红色固体 |
[交流与讨论]
(1)学生甲最终实验得到固体的成分是
CuO、Cu、Fe
CuO、Cu、Fe
;
(2)学生丙在加入铁粉后,发生反应的化学方程式:
Fe+H2SO4=FeSO4+H2↑;Fe+CuSO4=FeSO4+Cu;
Fe+H2SO4=FeSO4+H2↑;Fe+CuSO4=FeSO4+Cu;
;
(3)三位同学中制得铜质量最多的是
乙
乙
同学.你的分析理由是
8g氧化铜中含铜6.4g.甲实验中的氧化铜过量,加入5.6g铁,只能置换出3.2g铜;乙实验中,氧化铜、硫酸和铁均恰好完全反应,生成6.4g铜;丙实验中的硫酸过量,加入铁粉后,有一部分铁与硫酸反应生成硫酸亚铁,一部分铁与硫酸铜反应置换出铜,所以得到铜的实际质量小于6.4g,所以乙得到的铜最多
8g氧化铜中含铜6.4g.甲实验中的氧化铜过量,加入5.6g铁,只能置换出3.2g铜;乙实验中,氧化铜、硫酸和铁均恰好完全反应,生成6.4g铜;丙实验中的硫酸过量,加入铁粉后,有一部分铁与硫酸反应生成硫酸亚铁,一部分铁与硫酸铜反应置换出铜,所以得到铜的实际质量小于6.4g,所以乙得到的铜最多
.

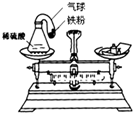 小明同学学了质量守恒定律后,自己查资料得知铁粉和稀硫 酸在常温下可反应生成硫酸亚铁和氢气,于是他设计了如图所示的实验,探究物质发生化学变化的前后,总质量是否发生了改变?请你和小明按下面的过程一起探究:
小明同学学了质量守恒定律后,自己查资料得知铁粉和稀硫 酸在常温下可反应生成硫酸亚铁和氢气,于是他设计了如图所示的实验,探究物质发生化学变化的前后,总质量是否发生了改变?请你和小明按下面的过程一起探究: