
题目列表(包括答案和解析)
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 加入稀盐酸质量(g) | 50 | 50 | 50 | 30 |
| 剩余固体的质量(g) | 17 | 9 | 5 | 5 |
| 100 |
| 44 |
| 8g |
| x |
| 100 |
| 44 |
| 8g |
| x |
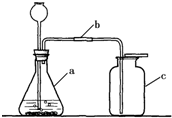 (2008?沐川县一模)如图是实验室用大理石与稀盐酸反应制取二氧化碳的实验装置图.请回答:
(2008?沐川县一模)如图是实验室用大理石与稀盐酸反应制取二氧化碳的实验装置图.请回答: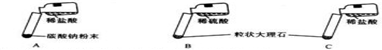
| 实验 | 实验现象 | 实验内容 |
| A | 剧烈反应,迅速放出大量气泡 | 反应速率过快,气体不便收集,不宜于实验室制取二氧化碳 |
| B | 产生气泡,速率迅速减慢,反应几乎停止. | 无法持续产生CO2,不能用于实验室制取CO2 |
| C | ① 产生大量气泡 产生大量气泡 |
② 反应速率适中,气体便于收集 反应速率适中,气体便于收集 |

| 猜想 | 实验步骤 | 实验现象及结论 |
氯化钙和盐酸 |
取少量,加石蕊试液 |
紫色石蕊试液变红,有盐酸和氯化钙 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com