37、复分解反应是我们学过的化学基本反应类型之一.学习时,应注意将知识进行归纳、总结,深刻理解复分解反应发生的条件,形成完整的知识体系.(已知BaS0
4难溶于水)(1)写出下列反应的化学方程式:
①氯化钡溶液与硫酸钠混合:
BaCl2+Na2SO4=BaSO4↓+2NaCl
:
②碳酸钾溶液与稀盐酸混合:
K2CO3+2HCl=2KCl+CO2↑+H2O
;
③氢氧化钡溶液与稀硝酸混合:
Ba(OH)2+2HNO3=Ba(NO3)2+2H2O
.
(2)你想过上述复分解反应为什么能够发生吗?这是因为在这些反应物中含有一些“特殊”的阴、阳离子,它们能相互结合.如上述反应①中,实际参加反应的离子是Ba
2+和S0
42一,而Cl
一、Na
+则是“旁观者”,并没有参加反应.请你分析上述反应②中实际参加反应的离子是
CO32-、H+
;上述反应③中实际参加反应的离子是
H+、OH-
.
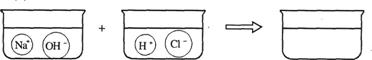
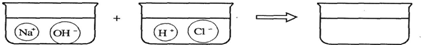
(3)请根据你的想象,在下图右边的容器中画出体现NaOH溶液和稀盐酸反应产物的示意图.