实验室有一瓶存放很久的生石灰,小丽同学想了解其变质情况,设计了实验,实验过程如下:
【实验1】取少量样品于烧杯中,加入足量水,感觉到烧杯变热,充分搅拌后过滤,得到白色沉淀和滤液.
小丽同学对样品的组成提出了以下假设:
假设1是CaO和CaCO
3的混合物;
假设2是CaO和Ca(OH)
2的混合物;
假设3是CaO和Ca(OH)
2、CaCO
3的混合物:
假设4是Ca(OH)
2和CaCO
3的混合物.
(1)直接可以看出,其中假设
4
4
不合理.
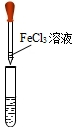
(2)为了判断其他几种假设的合理性,她继续进行实验:
【实验2】取少量沉淀放在试管中,加入稀盐酸,出现气泡,产生气体的反应的化学方程式为:
CaCO3+2HCl═CaCl2+H2O+CO2↑
CaCO3+2HCl═CaCl2+H2O+CO2↑
,由此可否定假设
2
2
.
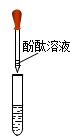
(3)为了得到最后结论,她继续进行实验:
【实验3】取少量滤液放在另一支试管中,加入无色酚酞试液,显红色,于是小丽同学得到结论:只有假设3合理,但小明同学提出,此实验仍不能得到最后结论.你赞成
小明
小明
同学的意见,原因是
CaO+H2O═Ca(OH)2,即使没有生成氢氧化钙,氧化钙与水反应也会生成氢氧化钙,使溶液呈碱性
CaO+H2O═Ca(OH)2,即使没有生成氢氧化钙,氧化钙与水反应也会生成氢氧化钙,使溶液呈碱性
.