
题目列表(包括答案和解析)
钼(元素符号Mo)是银灰色的难熔金属,常见化合价为+6、+5、+4,常温下钼在空气中很稳定,高于600 ℃时很快地氧化生成三氧化钼(MoO3);
辉钼精矿(主要成分为MoS2)是生产钼的主要原料。制取过程包括氧化焙烧,三氧化钼、钼粉和致密钼的制取等主要步骤,工艺流程如图:
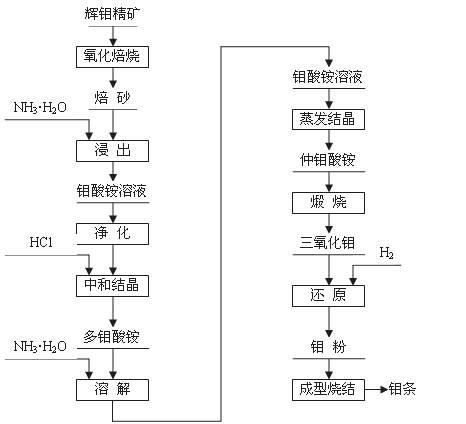
(1)辉钼精矿在600℃下进行氧化焙烧 转化为MoO3,同时产生SO2气体。主要反应的化学方程式为: 。钼冶炼厂对大气的污染主要来自于 ,你认为利用并处理该副产物的最好措施是
;
(2)三氧化钼的制取
将焙砂(主要成分:MoO3)用氨水浸出,与氨水反应生成钼酸铵[(NH4)2MoO4]溶液:反应的离子方程式为: ;
该反应: (填是或不是)氧化还原反应。
将所得钼酸铵[(NH4)2MoO4]溶液加热到55~65 ℃,用盐酸调节至溶液的pH为2,搅拌析出多钼酸铵[(NH4)2O?mMoO3?nH2O]晶体;为除去钙、镁、钠等杂质,将多钼酸铵重新溶于氨水形成钼酸铵,使氨挥发后生成仲钼酸铵晶体[(NH4)2O?7MoO3?4H2O],将仲钼酸铵晶体脱水、煅烧得纯度为99.95%的三氧化钼(MoO3)。
(3)金属钼粉的生产:
工业上在管状电炉中用氢气分两步还原三氧化钼得到钼粉:
① 在450~650℃下: MoO3 + 3H2 === MoO2 + 3H2O
② 在900~950 ℃下:MoO2 + 2H2 === Mo + 2H2O
某同学根据上述还原原理,认为还可用 等还原剂还原MoO3得到钼粉。
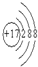
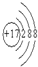
| ||
| ||
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com