
题目列表(包括答案和解析)
(08山东实验中学诊断)强酸和强碱在稀溶液里反应的热化学方程式可表示为:
H+(aq)+OH-(aq)=H2O(l); △H= -57.3 kJ?mol -1
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ;△H= -Q1 kJ?mol-1
HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ; △H= -Q2kJ?mol-1
上述均系在溶液中进行的反应,Q1、Q2的关系正确的是 ( )
A.Q1=Q2=57.3 B.Q1>Q2>57.3
C.Q1<Q2=57.3 D.无法确定
A.在稀溶液中所有酸和碱反应的中和热都相等
B.在稀溶液中强酸和强碱反应的中和热都相等
C.在稀溶液中1 mol酸和1 mol碱反应放出的热量都相等
D.将浓硫酸滴入氢氧化钠溶液中刚好生成1 mol水时,产生的热量即为中和热
A.在稀溶液中所有酸和碱反应的中和热都相等
B.在稀溶液中强酸和强碱反应的中和热都相等
C.在稀溶液中1 mol酸和1 mol碱反应放出的热量都相等
D.将浓硫酸滴入氢氧化钠溶液中刚好生成1 mol水时,产生的热量即为中和热
| |||||||||||||||||||||||||||||||||||||
清洗和制绒是硅晶片制作的重要步骤之一,硅片化学清洗的主要目的是除去硅片表面杂质(如某些有机物,无机盐,金属、Si、SiO2粉尘等)。常用的化学清洗剂有高纯水、有机溶剂、双氧水、浓酸、强碱等。其中去除硅的氧化物,通常用一定浓度的HF溶液,室温条件下将硅片浸泡1至数分钟。制绒是在硅片表面形成金字塔形的绒面,增加硅对太阳光的吸收。单晶制绒通常用NaOH、Na2SiO3等混合溶液在75~90℃反应25~35 min,效果良好。回答下列问题
Ⅰ.(1)写出晶片制绒反应的离子方程式 ,对单晶制绒1990年化学家Seidel提出了一种的电化学模型,他指出Si与NaOH溶液的反应,首先是Si与OH一反应,生成SiO44一,然后SiO44一迅速水解生成H4SiO4。基于此原理分析反应中氧化剂为 。
(2)本校化学兴趣小组同学,为验证Seidel的理论是否正确,完成以下实验:
|
|
实验事实 |
|
事实一 |
水蒸汽在600℃时可使粉末状硅缓慢氧化并放出氢气。 |
|
事实二 |
盛放于铂或石英器皿中的纯水长时间对粉末状还原硅无腐蚀作用。 |
|
事实三 |
普通玻璃器皿中的水仅因含有从玻璃中溶出的微量的碱便可使粉末状硅在其中缓慢溶解。 |
|
事实四 |
在野外环境里,用较高百分比的硅铁粉与干燥的Ca(OH)2和NaOH,点着后焖烧,可剧烈放出H2。 |
|
事实五 |
1g(0.036mo1)Si和20mL含有lgNaOH(0.025mol)的溶液,小心加热(稍微预热),收集到约1700mL H2,很接近理论值(1600mL)。 |
结论:从实验上说明碱性水溶液条件下,H2O可作 剂;NaOH作_____ 剂,降低反应 。高温无水环境下,NaOH作 剂。
Ⅱ.在工业中利用镁制取硅:2Mg+SiO2 2MgO+Si,同时有副反应发生:2Mg+Si
2MgO+Si,同时有副反应发生:2Mg+Si Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体。如图是进行Mg与SiO2反应的实验装置:
Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体。如图是进行Mg与SiO2反应的实验装置:
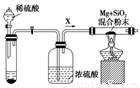
由于氧气的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。 a.石灰石 b.锌粒 c.纯碱
(4)实验开始时,必须先通入X气体,再加热反应物,其理由是______________________________,当反应开始后,移走酒精灯反应能继续进行,其原因是___________________________。
(5)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸。可观察到闪亮的火星,产生此现象的原因用化学方程式表示为_______________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com