
题目列表(包括答案和解析)
化学反应速率与化学平衡在日常生活、工农业生产和科学研究中具有重要的意义,在
化学实验中涉及的电离平衡也属于化学平衡。请回答下列问题:
(1)某研究性学习小组查阅资料发现金属氧化物A也能催化氯酸钾的分解,且A和二
氧化锰的最佳催化温度均为500℃左右。于是对A和二氧化锰的催化性能进行了
定量对照实验。实验时均以收满500 mL氧气为准(其他可能影响实验的因素均已
忽略)。
表一 用MnO2作催化剂
| 实验序号 | KClO3质量/g | MnO2质量/g | 反应温度/℃ | 待测数据 |
| 1 | 8.00 | 2.00 | 500 | |
| 2 | 8.00 | 2.00 | 500 |
表二 用A作催化剂
| 实验序号 | KClO3质量/g | A的质量/g | 反应温度/℃ | 待测数据 |
| 1 | 8.00 | 2.00 | 500 | |
| 2 | 8.00 | 2.00 | 500 |
请回答:上述实验中的待测数据应是 。
完成此研究后,他们准备发表一篇研究报告,请你替他们拟一研究报告的标题:
。
(2)氨水是一种弱碱,某同学取0.1mo/L的氨水,用pH试纸测其pH,结果发现溶液的
pH约为11,以此得出氨水为弱碱的结论。该同学用pH试纸测定氨水pH的具体操
作是 。
(3)证明氨水是弱碱的常用方法还有两种:一是设法证明NH![]() 的水解,一是设法使氨水
的水解,一是设法使氨水
电离平衡发生移动。
方法一:取少量NH4Cl晶体溶于水,滴入石蕊试液,溶液变红,可见溶液显酸性。
其原因是 。
方法二:取少量氨水,滴入酚酞变红后再加入 ,振荡,红色变浅,c(OH—)下降,说明氨水的电离平衡向 移动。
| 1 |
| 10000 |
| 1 |
| 10000 |
| 序号 | 元素 | 结构及性质 | ||
| ① | A | A的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 | ||
| ② | B | B原子最外层电子数是内层电子总数的
| ||
| ③ | C | C的氧化物是两性氧化物,且作为耐火材料 | ||
| ④ | D | A、D、E组成的36电子的化合物甲是家用消毒剂的主要成分 | ||
| ⑤ | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 | ||
| ⑥ | F | F元素最高正价与最低负价的代数和为4 |
| 实验编号 | 温度/℃ | 加入试剂 | 加入Y的量 |
| ① | 5 | 2滴 1mol/L FeCl3溶液 | 4mL 10% 的Y溶液 |
| ② | 40 | 2滴1mol/L FeCl3溶液 | 4mL 10% 的Y溶液 |
| ③ | 40 | 2滴1mol/L FeCl3溶液 2mL X |
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
(1)该反应的离子方程式为(提示:H2C2O4的一级电离平衡常数为5.4×10-2)
________.
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.
实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表:
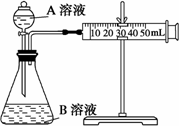
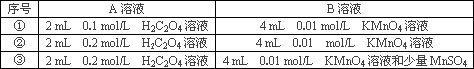
该实验探究的是________对化学反应速率的影响.在反应停止之前,相同时间内针管中所得CO2的体积由大到小的顺序是________(用实验序号填空).
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小.
取两支试管各加入2 mL 0.1 mol/L H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液.将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究________对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是________.
相同温度下,在四个密闭容器中发生可逆反应:H2(g)+I2(g) 2HI(g),实验测得起始、平衡时的有关数据如下表所示:
2HI(g),实验测得起始、平衡时的有关数据如下表所示:
|
容器编号[来源:学_科_网] |
起始时各物质的物质的量(mol)[来源:ZXXK][来源:学_科_网Z_X_X_K][来源:学|科|网] |
达平衡时体系的变化[来源:学+科+网Z+X+X+K] |
||
|
I2 |
H2 |
HI |
||
|
① |
1 |
3 |
0 |
放出热量:Q1=23.15kJ |
|
② |
0.8 |
2.8 |
0.4 |
平衡时碘化氢的体积分数为20% |
|
③ |
0 |
4 |
4 |
|
|
④ |
2 |
3 |
0 |
|
(1)下列叙述正确的是
A.四个容器中反应的平衡常数相等
B.反应的热化学方程式为:H2(g)+I2(g) 2HI(g) △ H =23.15kJ/mol
2HI(g) △ H =23.15kJ/mol
C.平衡时,容器④中H2的转化率高于① D、容器②中达平衡时放出的热量Q2<23.15kJ
E、达到平衡后若将容器①的体积变为0.25 L,H2的转化率提高
(2)该温度下,在容积为1L密闭容器③中发生反应建立平衡,若达到平衡所需的时间为2min,则平均反应速率v(HI)= ,该温度下,反应H2(g)+I2(g) 2HI(g)的平衡常数 K=
。
2HI(g)的平衡常数 K=
。
(3)平衡常数K只受温度的影响,与浓度、压强等因素无关,故可利用平衡常数来判断平衡是否移动及移动的方向。例如,若③为一个装有可移动活塞的容器,上述平衡达成后用外力将活塞向内推至容积为0.5L并恢复原温度,则由于
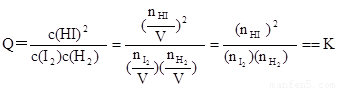 ,
,
可判断平衡将 (填“正向”、“逆向”或“不”)移动。
(4)如果保持温度和压强不变,向③的平衡体系中加入1.6molI2,平衡将 (填“正向”、“逆向”或“不”)移动,理由是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com