
题目列表(包括答案和解析)
实验室配制一定物质的量浓度的烧碱溶液,在下列各种情况下,所得溶液的物质的量浓度将如何变化(填“偏高”、“偏低”或“无影响”)
(1)在天平两托盘上分别垫上纸质、大小相同的两片纸,再将氢氧化钠固体放在纸上称量________.
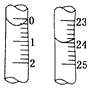
(2)定容时,俯视观察刻度线________.
(3)在倒入氢氧化钠溶液前,容量瓶中有少量水,未经干燥________.
(4)在容量瓶中加水至刻度线后,振荡,发现液体凹面低于刻度线,再用胶头滴管加蒸馏水至刻度线________.
(5)将配制好的溶液转移至刚洗净的试剂瓶________.
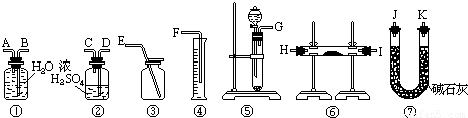

| CaCO3用量 | 未加CaCO3时 | 加约四分之一时 | 加一半时 | 全部加完时 |
| 读数/g | 318.3 | 325.3 | 334.5 | 359.5 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com