
题目列表(包括答案和解析)

试回答下列问题:
(1)在NaCl晶体中,每个Na+同时吸引个________Cl-,而Na+数目与Cl-数目之比为__________。
(2)Na+半径与Cl-半径之比![]() =__________。(已知
=__________。(已知![]() =1.414,
=1.414,![]() =1.732,
=1.732,![]() =2.236)
=2.236)
(3)NaCl晶体不存在分子,但在温度达到1 413 ℃时,NaCl晶体形成气体,并以分子形式存在,现有29.25 g NaCl晶体,强热使温度达到1 450 ℃,测得气体体积为5.6 L(已折算为标准状况),则此时氯化钠气体的分子式(化学式)为__________。

 = 1.414,
= 1.414,  =1.732,
=1.732, 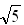 =2.236)
=2.236) (2004·烟台)在离子晶体中,阴、阳离子按一定规律在空间排列,下图A是NaCl的晶体结构,在离子晶体中,阴、阳离子具有或近似具有球形对称结构,它们可以被看作是不等径的刚性圆球,并彼此相切如NaCl晶体结构如图B,已知a为常数.

(1)在NaCl晶体中,每个 同时吸引_______个
同时吸引_______个 ;而
;而 数目和
数目和 数目之比为_______.
数目之比为_______.
(2) 半径与
半径与 半径之比
半径之比 =______________(已知
=______________(已知 ).
).
(3)NaCl晶体中不存在分子,但在 ,1 413℃时,NaCl晶体形成气体,并以分子形式存在.现有29.25g NaCl晶体,在
,1 413℃时,NaCl晶体形成气体,并以分子形式存在.现有29.25g NaCl晶体,在 时强热使温度达到1 501.5℃,测得气体体积为36.4L,试应用有关物理、化学知识计算此时氯化钠气体的分子式(化学式)为______(不写计算过程).
时强热使温度达到1 501.5℃,测得气体体积为36.4L,试应用有关物理、化学知识计算此时氯化钠气体的分子式(化学式)为______(不写计算过程).
(4)若 ,求NaCl晶体的密度(已知
,求NaCl晶体的密度(已知 ,NaCl的摩尔质量为
,NaCl的摩尔质量为 ).
).
(15分) A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素在 C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
① A中含有的金属元素的原子结构示意图为 。
② 该金属元素的单质与某红色氧化物在高温下反应,可用于焊接铁轨及定向爆破,已知:1mol该单质完全反应,当温度恢复至298K时,共放热QkJ,请写出该反应的热化学反应方程式为 。
(2)若A为有机物,75%的A溶液可作为消毒剂,常温常压下B、C均为无色气体,C是一种常见的灭火剂。则A的结构简式为: ;利用原电池原理,将B、X分别通入由A制成的两多孔电极,以20%—30%的KOH溶液作为电解质溶液,可以组成化学电源,该电池放电时,负极电极反应式为 。
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①用化学方程式表明C溶液呈碱性的原因 。
②将4.48 L(标准状况下)X通入100 mL3 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为 。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为___________________。
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。请针对以下三种不同情况回答:
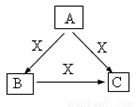
(1)若A、B、C中均含同一种常见金属元素,该元素在 C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素的原子结构示意图为 。
②该金属元素的单质与某红色氧化物在高温下反应,可用于焊接铁轨及定向爆破,已知:1mol该单质完全反应,当温度恢复至298K时,共放热QkJ,请写出该反应的热化学反应方程式为 。
(2)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①用化学方程式表明B溶液呈碱性的原因 。
②自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为___________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com