
题目列表(包括答案和解析)
 下图中,A、B、C、D、E、F在常温时均为气体,A、B分子中的电子数相同,G、H均为含氧化合物,其中反应生成的水及含铜化合物均略去,反应条件未注明。
下图中,A、B、C、D、E、F在常温时均为气体,A、B分子中的电子数相同,G、H均为含氧化合物,其中反应生成的水及含铜化合物均略去,反应条件未注明。
试根据上图各物质间的变化回答下列问题:
(1)写出X的化学式__________________________
(2)写出物质C和Y的电子式:C 、Y ;
(3)反应I的化学方程式__________________________________________________ ;
(4)反应Ⅱ的离子方程式__________________________________________________ ;
(5)在上述各步反应中,有两种物质既做氧化剂又做还原剂,它们是________、______。
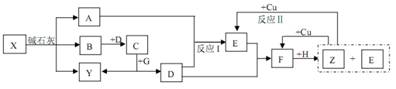 下图中,A、B、C、D、E、F在常温时均为气体,A、B分子中的电子数相同,G、H均为含氧化合物,其中反应生成的水及含铜化合物均略去,反应条件未注明。
下图中,A、B、C、D、E、F在常温时均为气体,A、B分子中的电子数相同,G、H均为含氧化合物,其中反应生成的水及含铜化合物均略去,反应条件未注明。
试根据上图各物质间的变化回答下列问题:
(1)写出X的化学式__________________________
(2)写出物质C和Y的电子式:C 、Y ;
(3)反应I的化学方程式__________________________________________________ ;
(4)反应Ⅱ的离子方程式__________________________________________________ ;
(5)在上述各步反应中,有两种物质既做氧化剂又做还原剂,它们是________、______。
复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
溶质 | CH3COONa | NaHCO | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2![]() CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是_______________________(填编号)。
CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是_______________________(填编号)。
A.CO2+H2O +2NaClO=Na2CO3+2HClO
B.CO2+H2O +NaClO=NaHCO3+HClO
C.CO2 +H2O +C6H5ONa ![]() NaHCO3+C6H5OH
NaHCO3+C6H5OH
D.CO2 +H2O +2C6H5ONa ![]() Na2CO3+2C6H5OH
Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH ![]() NaHCO3+C6H5Ona
NaHCO3+C6H5Ona
F.CH3COOH+NaCN=CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05 mol/L的下列六种物质的溶液中,pH最小的是______(填编号);其pH为___________(填数值);pH最大的是_________(填编号)。
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H![]() 2SO4 ⑥HClO4
2SO4 ⑥HClO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出N![]() aCl晶体根据上述反应,总结出复分解反应发生的另一规律: ;
aCl晶体根据上述反应,总结出复分解反应发生的另一规律: ;
将KI溶液和AgCl固体混合搅拌,会观察到的现象是 ,
请写出反应的离子方程式: 。
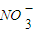

在上述转化关系中,已知B、D都是淡黄色固体,且A与D可反应生成离子化合物。回答。
(1)写出下列物质的化学式:
A__________;F___________;H___________。
(2)写出C的电子式___________。
(3)写出B到C,E到F的化学方程式; ______________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com