
题目列表(包括答案和解析)
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素是原子半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题:
(1)C和E两元素相比较,非金属性较强的是 (填元素名称),可以验证该结论的是 (填写编号);
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的原子的电子层数
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢化合的难易
(2)C、D两元素形成的原子个数比为1:1的化合物与C、E两元素形成的两种化合物都能反应,且有一种共同的产物,写出这两个反应的化学方程式:
; 。
(3)A、B、C、E四种元素可形成两种酸式盐,两种酸式盐相互反应的离子方程式为 ,X的水溶液呈 性,原因是(用离子方程式表示) 。
(4)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(5)D元素的气态氢化物和其低价氧化物能反应生成D的单质,该反应中氧化产物与还原产物的物质的量之比为 。
(6)①在火箭推进器中装有液态B2A4和液态A2C2,已知0.4mol.液态B2A4和足量液态A2C2反应,生成气态B2和气态A2C,放出256.6kJ的热量。试写出该反应的热化学方程式: 。
②B2A4又称为肼,是一种可燃性液体,肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%―30%的KOH溶液,该电池放电时的电极反应式为:正极 ,负极 。
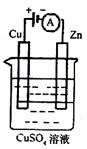
右图是一个电化学过程示意图。
1)锌片上发生的电极反应式为 。
2)假设使用肼一空气燃料电池作为本过程中的电源,铜片的质量变化为128g,则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设空所中氧气体积含量为20%)。
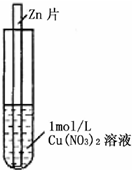 (2011?上饶二模)如图,将一锌片放入1mol?L-1蓝色Cu(NO3)2溶液中,观察到下列实验现象:①反应初期锌片上有大量气泡冒出,同时液面的上一层Cu(NO3)2溶液开始呈现绿色,并且逐渐向液面下的深处扩散,试管底部有红色固体出现.②与锌片接触的溶液温度明显升高,反应越来越剧烈,并在红色固体上方开始出现一层蓝色沉淀,并逐渐增多.③反应后期溶液逐渐变为无色,试管底部又有部分白色沉淀物.
(2011?上饶二模)如图,将一锌片放入1mol?L-1蓝色Cu(NO3)2溶液中,观察到下列实验现象:①反应初期锌片上有大量气泡冒出,同时液面的上一层Cu(NO3)2溶液开始呈现绿色,并且逐渐向液面下的深处扩散,试管底部有红色固体出现.②与锌片接触的溶液温度明显升高,反应越来越剧烈,并在红色固体上方开始出现一层蓝色沉淀,并逐渐增多.③反应后期溶液逐渐变为无色,试管底部又有部分白色沉淀物.Ⅰ.生活中常用药品很多,如:①碘酒、②青霉素、③阿司匹林、④葡萄糖注射液、⑤抗酸药(主要成分为碳酸氢钠)。
⑴上述物质中属于抗生素的是 (填写序号)
⑵碳酸氢钠可防治胃酸分泌过多,其发挥功效时的离子方程式为 。
⑶邻羟基苯甲酸的结构式为  ,俗名为水杨酸,在医学上具有解热镇痛和抗炎、抗风湿作用,由于它具有酸性而刺激胃肠道产生严重的反应,因此通常将它先转化为乙酰水杨酸(阿司匹林),服用后在人体内会缓慢反应生成水杨酸:
,俗名为水杨酸,在医学上具有解热镇痛和抗炎、抗风湿作用,由于它具有酸性而刺激胃肠道产生严重的反应,因此通常将它先转化为乙酰水杨酸(阿司匹林),服用后在人体内会缓慢反应生成水杨酸:

据此,请回答:
这个反应的反应类型为 。
有时,生产厂家将乙酰水杨酸制成其钠盐或钙盐,目的是 ,以防止刺激胃黏膜。
(4)下列关于药物使用的说法中,正确的是__________。(填写序号)
A.碘酒能使蛋白质变性,常用于外敷消毒
B.长期大量服用阿司匹林可预防疾病,没有毒副作用
C.使用青霉素可直接静脉注射,不需进行皮肤敏感试验
D.随着平价药房的开设,生病了都可以到药店自己买药服用,不用到医院就诊
Ⅱ.糖类是人体需要的重要营养素,淀粉是重要的一类糖。
在试管中加入0.5g淀粉和4mL20%的H2SO4溶液,加热3~4min,然后用碱液中和试管中的H2SO4溶液。请回答下列问题:
(1)下列物质富含淀粉的是 (填“大米”或“青菜”或“猪肉”)
(2)淀粉完全水解生成有机物的化学式为 。淀粉水解产物在体内被氧化的化学方程式为___________________________________。
(3)若要检验淀粉没有完全水解,可取少量上述溶液加入 (填试剂的名称),应观察到 。
Ⅲ.获得洁净安全的饮用水是每个人的正常需要。某农村地区为获得饮用水,在将地表水取回家后,常使用漂白粉或漂白精片进行杀菌消毒,其原理可用化学方程式表示为 。
Ⅳ.钢铁的生产与使用是人类文明和生活进步的一个重要标志。
(1)工业炼铁的主要化学反应方程式为 。
(2)炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑。试回答:
①铁锅的腐蚀主要是由 腐蚀造成的。
②铁锅锈蚀的负极反应式为 。
(3)为防止轮船的船体在海水中腐蚀,一般在船身连接 (填“锌块”或“铜块”)。
Ⅰ.生活中常用药品很多,如:①碘酒、②青霉素、③阿司匹林、④葡萄糖注射液、⑤抗酸药(主要成分为碳酸氢钠)。
⑴上述物质中属于抗生素的是 (填写序号)
⑵碳酸氢钠可防治胃酸分泌过多,其发挥功效时的离子方程式为 。
⑶邻羟基苯甲酸的结构式为  ,俗名为水杨酸,在医学上具有解热镇痛和抗炎、抗风湿作用,由于它具有酸性而刺激胃肠道产生严重的反应,因此通常将它先转化为乙酰水杨酸(阿司匹林),服用后在人体内会缓慢反应生成水杨酸:
,俗名为水杨酸,在医学上具有解热镇痛和抗炎、抗风湿作用,由于它具有酸性而刺激胃肠道产生严重的反应,因此通常将它先转化为乙酰水杨酸(阿司匹林),服用后在人体内会缓慢反应生成水杨酸:

据此,请回答:
这个反应的反应类型为 。
有时,生产厂家将乙酰水杨酸制成其钠盐或钙盐,目的是 ,以防止刺激胃黏膜。
(4)下列关于药物使用的说法中,正确的是__________。(填写序号)
A.碘酒能使蛋白质变性,常用于外敷消毒
B.长期大量服用阿司匹林可预防疾病,没有毒副作用
C.使用青霉素可直接静脉注射,不需进行皮肤敏感试验
D.随着平价药房的开设,生病了都可以到药店自己买药服用,不用到医院就诊
Ⅱ.糖类是人体需要的重要营养素,淀粉是重要的一类糖。
在试管中加入0.5g淀粉和4mL20%的H2SO4溶液,加热3~4min,然后用碱液中和试管中的H2SO4溶液。请回答下列问题:
(1)下列物质富含淀粉的是 (填“大米”或“青菜”或“猪肉”)
(2)淀粉完全水解生成有机物的化学式为 。淀粉水解产物在体内被氧化的化学方程式为___________________________________。
(3)若要检验淀粉没有完全水解,可取少量上述溶液加入 (填试剂的名称),应观察到 。
Ⅲ.获得洁净安全的饮用水是每个人的正常需要。某农村地区为获得饮用水,在将地表水取回家后,常使用漂白粉或漂白精片进行杀菌消毒,其原理可用化学方程式表示为 。
Ⅳ.钢铁的生产与使用是人类文明和生活进步的一个重要标志。
(1)工业炼铁的主要化学反应方程式为 。
(2)炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑。试回答:①铁锅的腐蚀主要是由 腐蚀造成的。
②铁锅锈蚀的负极反应式为 。
(3)为防止轮船的船体在海水中腐蚀,一般在船身连接 (填“锌块”或“铜块”)。
小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”.
(1)实验前小明预测说:
Fe2‘肯定既有还原性又有氧化性.你认为他预测的依据是:________(2)小明欲用实验证明他的预测.实验室提供了下列试剂:3%的
H2O2溶液、锌粒、铜片、0.1mol·Ll FeCl2溶液、KSCN溶液、新制氯水.①若小明计划在0.
1 mol·L1 FeCl2溶液滴入新制氯水,探究Fe.的还原性,你预计可能发生的反应和现象是:(写离子方程式)、溶液由浅绿色变________色.②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验
Fe2,被氧化的产物Fe3+的存在以获取证据.你认为可选________滴入小明所得的混合液中,并通过溶液出现________色的现象,证明小明的观点和实验方案都是正确的.③对于证明Fe2,具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入
FeCL溶液中,结果铜片没变化,锌粒逐渐变小.由此说明三种金属的还原性由强至弱的顺序为________.(3)
小明分析H2O2中氧元素显-1价(中间价),并提出疑问:H2O2与FeCl2的反应时,Fe2t还作氧化剂吗?①请你为小明梳理相关问题:若Fe在反应中表现出氧化性应转化成________(填微粒符号,下同),若
Fe2t在反应中表现出还原性应转化成________.②实际上
Fe2+还原性较强,实验室的FeCl2溶液常因氧化而变质.除杂的方法是:________,相关反应的离子方程式:________.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com