
题目列表(包括答案和解析)
 铅蓄电池是最常见的二次电池,它是由两组平行排列的栅状铅合金极板作为主架,正极板上覆盖PbO2,负极板上覆盖Pb,电解质是硫酸.电池总反应式为:Pb+PbO2+4H++2SO42-
铅蓄电池是最常见的二次电池,它是由两组平行排列的栅状铅合金极板作为主架,正极板上覆盖PbO2,负极板上覆盖Pb,电解质是硫酸.电池总反应式为:Pb+PbO2+4H++2SO42- | 放电 | 充电 |
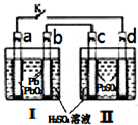
(Ⅰ)某铅蓄电池的正、负极标记被磨损.试用下图装置设计实验,识别出此铅蓄电池的正负极.

(1)若A接E,B接F,而B电极出现________,反应式为________,则说明F为正极;
(2)铅蓄电池工作时(放电),其E所在电极的电极反应式为:________,充电时该极与外加电源的________极相连;
(3)若有0.2 mol电子发生转移,则正极消耗的PbO2的物质的量是________;
(Ⅱ)利用甲醇(CH3OH)、氧气组成燃料电池,电解质溶液为碱性,电池工作时,其负极方程式(写离子方程式)为________.
(Ⅲ)一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH+H2O→CH3COOH+4H++4e-.正极的反应式:________;电池反应的总方程式为:________.
 PbCO3(s)+SO42-(aq)某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
PbCO3(s)+SO42-(aq)某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。 

工业上从废铅蓄电池的铅膏回收铅的过程中,可用碳酸盐溶液与处理后的铅膏(主要成分为PbSO4)发生反应:![]() 。某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
。某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
(l)上述反应的平衡常数表达式:K=__ __
(2)室温时,向两份相同的PbSO4样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化。在 溶液中PbSO4转化率较大,理由是
(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3·Pb(OH)2],它和PbCO3受热都易分解生成PbO。该课题组对固体产物(不考虑PbSO4)的成分提出如下假设。请你完成假设二和假设三:
假设一:全部为PbCO3;
假设二: ;
假设三: 。
(4)为验证假设一是否成立,课题组进行如下研究
①定性研究:请你完成下表中内容
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取一定量样品充分干燥,…… |
②定量研究:取26.7 mg的干燥样品,加热,测得固体质量随温度的变化关系如下图。某同学由图中信息得出结论:假设一不成立。你是否同意该同学的结论,并简述理由:
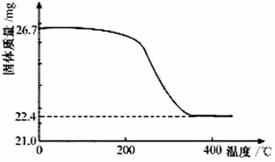
 飞机、汽车、拖拉机、坦克,都是用蓄电池作为照明光源是典型的可充型电池,总反应式为:
飞机、汽车、拖拉机、坦克,都是用蓄电池作为照明光源是典型的可充型电池,总反应式为:
| ||
| 充电 |
| 实验内容 | 实验方法 | 实验现象及原因分析 |
| ①碘离子浓度增大对平衡的影响 | 取PbI2饱和溶液少量于一支试管中,再加入少量NaI饱和溶液, 取PbI2饱和溶液少量于一支试管中,再加入少量NaI饱和溶液, |
溶液中出现黄色浑浊. 原因是溶液中c(I-)增大,使Qc大于了pbI2的Ksp 溶液中出现黄色浑浊. 原因是溶液中c(I-)增大,使Qc大于了pbI2的Ksp |
| ②铅离子浓度减小对平衡的影响 | 取PbI2悬浊液少量于一支试管中,再加入少量NaCl饱和溶液 取PbI2悬浊液少量于一支试管中,再加入少量NaCl饱和溶液 |
黄色浑浊消失 原因是形成PbCl42-,导致溶液中c(Pb2+)减小,使Qc小于了pbI2的Ksp 黄色浑浊消失 原因是形成PbCl42-,导致溶液中c(Pb2+)减小,使Qc小于了pbI2的Ksp |
| ③ 铅离子和碘离子浓度都减小对平衡的影响 铅离子和碘离子浓度都减小对平衡的影响 |
在PbI2悬浊液中加入少量FeCl3饱和溶液 | PbI2 +2Fe3++4Cl-=PbCl42-+2Fe2++I2 PbI2 +2Fe3++4Cl-=PbCl42-+2Fe2++I2 |
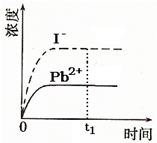 ④已知室温下PbI2的Ksp=8.0×10-9,将适量PbI2固体溶于 100mL水中至刚好饱和,该过程中Pb2+和I-浓度随时间变化关系如图(饱和PbI2溶液中c(I-)=0.0025mol?L-1).若t1时刻在上述体系中加入100mL.、0.020mol?L-1 NaI 溶液,画出t1时刻后Pb2+和I-浓度随时间变化关系图.
④已知室温下PbI2的Ksp=8.0×10-9,将适量PbI2固体溶于 100mL水中至刚好饱和,该过程中Pb2+和I-浓度随时间变化关系如图(饱和PbI2溶液中c(I-)=0.0025mol?L-1).若t1时刻在上述体系中加入100mL.、0.020mol?L-1 NaI 溶液,画出t1时刻后Pb2+和I-浓度随时间变化关系图.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com