
题目列表(包括答案和解析)
高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。其制备路线如下: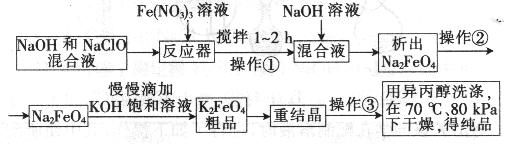
试回答下列问题
(1)操作①后的混合液中加入NaOH溶液的作用是: 。
最后用异丙醇洗涤产品的目的是 。
(2) 操作②与操作③相同,该操作名称是:___________________。
(3)反应器中,NaOH、NaClO及Fe(NO3)3反应的离子方程式为: _____________________。
(4)次氯酸钠浓度对高铁酸钾产率有一定影响(下图甲),当高铁酸钾产率最高时,NaClO的物质的量浓度约为_________。(计算结果保留一位小数)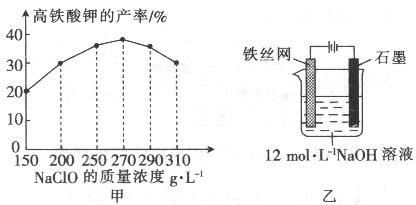
(5)从环境保护的角度看,制备中间产物Na2FeO4较好的方法为电化学法,其装置如图乙所示,则阳极的电极反应式为 。
高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。其制备流程如下:

试回答下列问题
(1)反应器中,NaOH、NaClO、Fe(NO3)3发生反应生成Na2FeO4,完成并配平下列离子反应方程式:
□Fe3++□ClO─+□OH─ ==□FeO42─+□Cl─+□___________
(2)次氯酸钠浓度对高铁酸钾产率有一定影响,当NaClO浓度为298g/L时,高铁酸钠的产率最高,此时NaClO的物质的量浓度为_______________。
(3)你认为操作①能够发生转化的原因是__________,慢慢滴加的原因的是___________。
(4)操作②如果温度过高会造成高铁酸钾的分解,高铁酸钾受热分解时生成金属氧化物和氧气,该反应的化学方程式为__________________。
(5)可以用电化学法制取Na2FeO4,其装置如图所示,则阳极的电极反应式为 ;
阴极的电极反应式为______________;电解一段时间后溶OH─的浓度会_________(填“升高”、“降低”
或“不变”)。

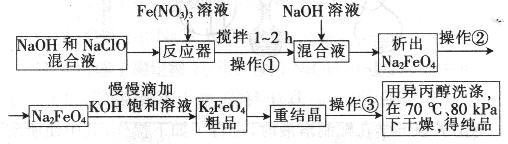
高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。其制备路线如下:
试回答下列问题
(1)操作①后的混合液中加入NaOH溶液的作用是: 。
最后用异丙醇洗涤产品的目的是 。
(2) 操作②与操作③相同,该操作名称是:___________________。
(3)反应器中,NaOH、NaClO及Fe(NO3)3反应的离子方程式为: _____________________。
(4)次氯酸钠浓度对高铁酸钾产率有一定影响(下图甲),当高铁酸钾产率最高时,NaClO的物质的量浓度约为_________。(计算结果保留一位小数)
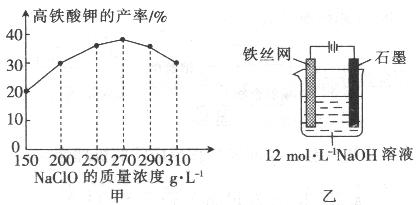
(5)从环境保护的角度看,制备中间产物Na2FeO4较好的方法为电化学法,其装置如图乙所示,则阳极的电极反应式为 。
高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。其制备路线如下:
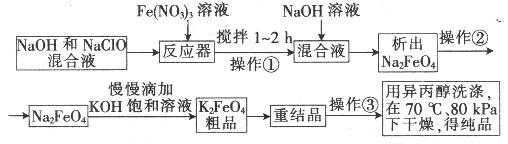
试回答下列问题
(1)操作①搅拌的目的是: 。
(2)操作②与操作③相同,该操作名称是:___________________。
(3)反应器中, NaOH、NaClO及Fe(NO3)3反应的离子方程式为: _______________________。
(4)次氯酸钠浓度对高铁酸钾产率有一定影响,当高铁酸钾产率最高时,NaClO的物质的量浓度约为_________。(计算结果保留一位小数)

(5)从环境保护的角度看,制备中间产物Na2FeO4较好的方法为电化学法,其装置如图乙所示,则阳极的电极反应式为 。
高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。其制备流程如下: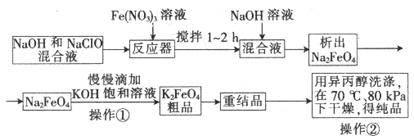
试回答下列问题
(1)反应器中,NaOH、NaClO、Fe(NO3)3发生反应生成Na2FeO4,完成并配平下列离子反应方程式:
□Fe3++□ClO─+□OH─ ==□FeO42─+□Cl─+□___________
(2)次氯酸钠浓度对高铁酸钾产率有一定影响,当NaClO浓度为298g/L时,高铁酸钠的产率最高,此时NaClO的物质的量浓度为_______________。
(3)你认为操作①能够发生转化的原因是__________,慢慢滴加的原因的是___________。
(4)操作②如果温度过高会造成高铁酸钾的分解,高铁酸钾受热分解时生成金属氧化物和氧气,该反应的化学方程式为__________________。
(5)可以用电化学法制取Na2FeO4,其装置如图所示,则阳极的电极反应式为 ;
阴极的电极反应式为______________;电解一段时间后溶OH─的浓度会_________(填“升高”、“降低”
或“不变”)。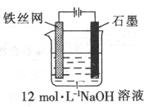
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com