
题目列表(包括答案和解析)

(1)、①用肼(N2H4)为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)=N2O4(g) ΔH=+10.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543kJ·mol-1
写出气态肼和N2O4反应的热化学方程式: 。
②已知四氧化二氮在大气中或在较高温度下很难稳定存在,其很容易转化为二氧化氮。试推断由二氧化氮制取四氧化二氮的反应条件(或措施): 。
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。
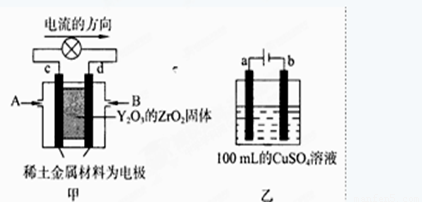
图甲所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e →2O2-)
①c电极为 ,d电极上的电极反应式为 。
②图乙是电解100mL 0.5mol·L-1 CuSO4溶液,a电极上的电极反应式为 。若a电极产生56mL(标准状况)气体,则所得溶液的pH= (不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入 (选填字母序号)
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
(1)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-―→2O2-)。
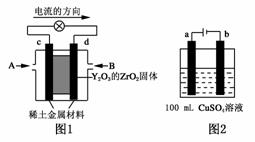
①c电极的名称为________,d电极上的电极反应式为 。
②如图2所示电解100mL 0.5mol·L-1 CuSO4溶液,a电极上的电极反应式 。若a电极产生56mL(标准状况)气体,则所得溶液的pH=________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入________(填字母序号)。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
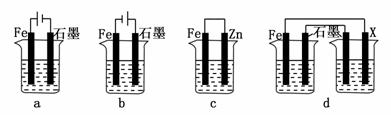
(2)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是________(填字母)。
②若用d装置保护铁,X极的电极材料应是________(填名称)。
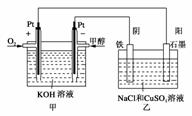
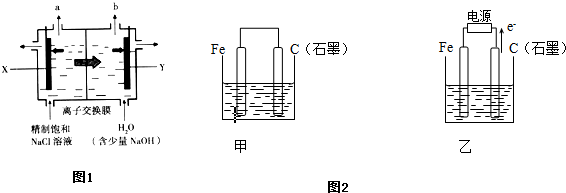
(3)某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如下图:
①写出甲中通入甲醇这一极的电极反应式 。
②理论上乙中两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式 ;在t2时所得溶液的pH约为________。
一定温度下,分别往容积均为5L的甲(恒压容器)、乙(恒容容器)中加入0.5mol无色的N2O4气体,立即出现红棕色。当反应进行到2s时,测得乙容器中N2O4的浓度为0.09mol?L-1。经过60s,乙容器中的反应达到平衡。(反应过程中两个容器的温度均保持恒定)
(1)容器中气体出现红棕色的原因是__________(用化学方程式表示)。
(2)前2s内乙容器中以N2O4的浓度变化表示的反应速率为_____________。
(3)达到平衡时,甲容器中反应所需的时间______60s(填“大于”、“小于”或“等于”,下同);容器内N2O4的浓度甲______乙。
(4)若要使甲、乙容器中N2O4浓度相等,不能采取的措施是__________。
A.保持温度不变,适当压缩甲容器的体积
B.保持容器体积不变,使甲容器升温
C.保持容器体积和温度不变,向甲容器中加入适量N2O4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com