
题目列表(包括答案和解析)
| 编号 | 实验目的 | 锌粒 | 温度 | c(H2SO4) | 需测量的数据 |
| Ⅰ | 为以下实验作参照 | 3粒 | 25℃ | c1 | a |
| Ⅱ | 探究温度对反应速率的影响 | 3粒 | 50℃ | c1 c1 |
b |
| Ⅲ | 探究浓度对反应速率的影响 | 3粒 | 25℃ 25℃ |
c2 | d |
(12分)车载甲醇质子交换膜燃料电池(PEMFC)将甲醇蒸气转化为氢气的工 艺有两种:(1)水蒸气变换(重整)法;(2)空气氧化法。两种工艺都得 到副产品CO。
1.分别写出这两种工艺的化学方程式,通过计算,说明这两种工艺的优缺点。有关资料(298 .15K)列于表3。
表3 物质的热力学数据
物质 | ΔfHm | Sm |
CH3OH(g) | -200.66 | 239.81 |
CO2(g) | -393.51 | 213.64 |
CO(g) | -110.52 | 197.91 |
H2O(g) | -241.82 | 188.83 |
H2 (g) | 0 | 130.59 |
2.上述两种工艺产生的少量CO会吸附在燃料电池的Pt或其他贵金属催化剂表面,阻碍H2的吸附和电氧化,引起燃料电池放电性能急剧下降,为此,开发了除去CO的方法。现有一组实验结果(500K)如表4。

表中PCO、PO2 分别为CO和O2的分压;rco为以每秒每个催化剂Ru活性位上所消耗的CO分子数表示的CO的氧化速率。(1)求催化剂Ru上CO氧化反应分别对CO和O2的反应级数(取整数),写出 速率方程。(2)固体Ru表面具有吸附气体分子的能力,但是气体分子只有碰到空活性位才可能发生吸附作用。当已吸附分子的热运动的动能足以克服固体引力场的势垒时,才能脱附,重新回到气相。假设CO和O2的吸附与脱附互不影响,并且表面是均匀的,以θ表示气体分子覆盖活性位的百分数(覆盖度),则气体的吸附速率与气体的压力成正比,也与固体表面的空活性位数成正比。研究提出CO在Ru上的氧化反应的一种机理如下:
 其中kco,ads、 kco,des分别为CO在Ru的活性位上的吸附速率常数和脱附速率常数,ko2,ads为O2在Ru的活性位上的吸附速率常数。M表示Ru催化剂表面上的活性位。CO在Ru表面活性位上的吸附比O2的吸附强得多。试根据上述反应机理推导CO在催化剂Ru表面上氧化反应的速率方程(不考虑O2的脱附;也不考虑产物CO2的吸附),并与实验结果比较。
其中kco,ads、 kco,des分别为CO在Ru的活性位上的吸附速率常数和脱附速率常数,ko2,ads为O2在Ru的活性位上的吸附速率常数。M表示Ru催化剂表面上的活性位。CO在Ru表面活性位上的吸附比O2的吸附强得多。试根据上述反应机理推导CO在催化剂Ru表面上氧化反应的速率方程(不考虑O2的脱附;也不考虑产物CO2的吸附),并与实验结果比较。
3.有关物质的热力学函数(298.15 K)如表5。
表5 物质的热力学数据
物质 | ΔfHm | Sm |
H2 (g) | 0 | 130.59 |
O2(g) | 0 | 205.03 |
H2O (g) | -241.82 | 188.83 |
H2O (l) | -285.84 | 69.94 |
在373.15K,100kPa下,水的蒸发焓Δvap Hm![]() =40.64kJ?mol-1,在298.15~3
=40.64kJ?mol-1,在298.15~3
73.15K间水的等压热容为75.6 J?K-1?mol-1。(1)将上述工艺得到的富氢气体作为质子交换膜燃料电池的燃料。燃料电池的理论效率是指电池所能做的最大电功相对于燃料反应焓变的效率。在298.15K,100 kPa下,当1 molH2燃烧分别生成H2O(l) 和 H2O(g)时,计算燃料电池工作的理论效率,并分析两者存在差别的原因。(2)若燃料电池在473.15 K、100 kPa下工作,其理论效率又为多少(可忽略焓 变和嫡变随温度的变化)?(3)说明(1)和(2)中的同一反应有不同理论效率的原因。
| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | Cu、稀硝酸 | NO | H2O |
| Ⅱ | NaOH(s)、浓氨水 | NH3 | |
| Ⅲ | 电石、饱和食盐水 | C2H2 | H2O |
| Ⅳ | 镁铝合金、NaOH溶液 | H2 | H2O |
| 编号 | 镁铝合金质量 | 量气管第1次读数 | 量气管第2次读数 |
| ① | 1.0g | 10.0mL | 347.5mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 344.5mL |
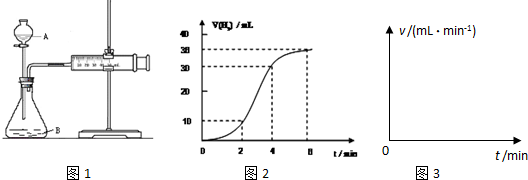
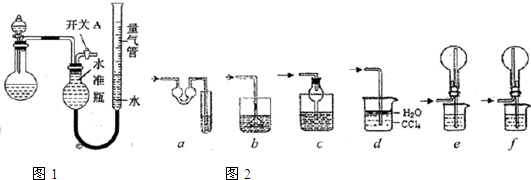
某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
 |
| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| Ⅰ | Cu、稀HNO3 | H2O | |
| Ⅱ | NaOH固体、浓氨水 | NH3 | |
| Ⅲ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
(1)实验过程中,使用分液漏斗滴加液体的操作是
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为
是否可行? (填“可行”或“不可行”),原因是
(3)实验Ⅱ中量气管中的液体最好是__ __(填字母编号,下同)
A.浓NaOH溶液 B.氨水 C.煤油 D.氯化铵溶液
该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,不能防止倒吸的是 .
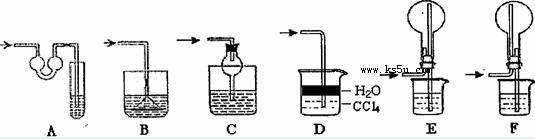
(4)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温,② ,③视线与凹液面最低处相平.
(5)写出实验Ⅲ中涉及的离子反应方程式
(6)实验Ⅲ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
根据上述数据,可计算出镁铝合金中铝的质量分数为__ __.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com