
题目列表(包括答案和解析)
(15分)(物质结构与性质)CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
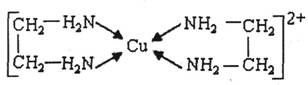
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:
请回答下列问题:
(1)基态Cu原子的核外电子排布式为 。H、N、O三种元素的电负性由大到小的顺序是 。
(2)SO2分子的空间构型为____________。与SnCl4互为等电子体的一种离子的化学式为
。
(3)乙二胺分子中氮原子轨道的杂化类型为 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_ 。
(4)②中所形成的配离子中含有的化学键类型有_______。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
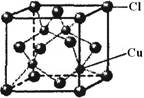
(5)CuCl的晶胞结构如右图所示,其中Cl原子的配位数为_____。
(15分)(物质结构与性质)CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
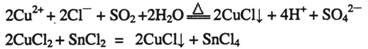
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:
请回答下列问题:
(1)基态Cu原子的核外电子排布式为 。H、N、O三种元素的电负性由大到小的顺序是 。
(2)SO2分子的空间构型为____________。与SnCl4互为等电子体的一种离子的化学式为
。
(3)乙二胺分子中氮原子轨道的杂化类型为 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_ 。
(4)②中所形成的配离子中含有的化学键类型有_______。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
(5)CuCl的晶胞结构如右图所示,其中Cl原子的配位数为_____。
 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.| 1 |
| 2 |
| 1 |
| 2 |
| 物质的量/(mol)/时间(h) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
氮是地球上极为丰富的元素。2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮,晶体片段结构如右图所示。每个氮原子都通过3个单键与其它氮原子结合并向空间发展构成立体网状结构。这种高聚氮的N-N键的键能为160kJ/mol,而N2的键能为942kJ/mol。

(1)请根据以上信息写出固态高聚氮爆炸成氮气的热化学方程式: 。
(2)N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-3,计算说明N2中的 键比 键稳定(填“![]() ”“
”“![]() ”)。
”)。
(3)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为 。
(4)2008的秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺
( )。
)。
下列关于三聚氰胺分子的说法中正确的是 。
A.所有碳原子采用sp2杂化,所有氮原子采用sp3杂化
B.一个分子中共含有15个σ键
C.属于极性分子,故极易溶于水
D.形成的晶体熔点较高
(5)继C60后,科学家又合成了N60、Si60、KnC60等,C、Si、N、K原子电负性由大到小的顺序是 > > > 。
(15分)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
①2H2(g)+CO(g)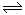 CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g)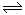 H2O(g)+CO(g) H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g)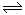 CH3OH(g)+H2O(g) CH3OH(g)+H2O(g) | K3 | | |
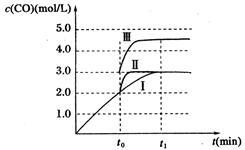
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com