
题目列表(包括答案和解析)
发展混合动力车是实施节能减排的重要措施之一。混合动力车可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1mol水蒸气放热569.1kJ。则该反应的热化学方程式为 。
(2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理如下图,其总反应式是:
H2+2NiOOH![]() 2Ni(OH)2。
2Ni(OH)2。

根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH将
(填“增大”、“不变”或“减小”),该电极的电极反应式为 ;在刹车和下坡时甲电极的电极反应为 。
(3)汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度:
(g)。已知:平衡时各物质的浓度关系有![]()
已知:平衡时各物质的浓度关系有![]() ,K是一个只与温度有关的常数,称为化学平衡常数。
,K是一个只与温度有关的常数,称为化学平衡常数。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请填写表中的空格。
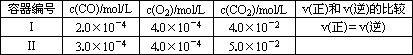
| 容器编 号 | c(CO)/ mol/L | c(O2)/ mol/L | c(CO2)/ mol/L | v(正)和v(逆)的比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)= v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 |
②相同温度下,某汽车尾气中CO、CO2的浓度分别为1.0×10-5 mol/L和1.0×10-4mol/L。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×10-4mol/L,则最终尾气中CO的浓度为 。
发展混合动力车是实施节能减排的重要措施之一。混合动力车可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1mol水蒸气放热569.1kJ。则该反应的热化学方程式为 。
(2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理如下图,其总反应式是:
H2+2NiOOH2Ni(OH)2。
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH将
(填“增大”、“不变”或“减小”),该电极的电极反应式为 ;在刹车和下坡时甲电极的电极反应为 。
(3)汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度:
(g)。已知:平衡时各物质的浓度关系有
已知:平衡时各物质的浓度关系有,K是一个只与温度有关的常数,称为化学平衡常数。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请填写表中的空格。
| 容器编 号 | c(CO)/ mol/L | c(O2)/ mol/L | c(CO2)/ mol/L | v(正)和v(逆)的比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)= v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 |
|
②相同温度下,某汽车尾气中CO、CO2的浓度分别为1.0×10-5 mol/L和1.0×10-4mol/L。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×10-4mol/L,则最终尾气中CO的浓度为 。
发展混合动力车是实施节能减排的重要措施之一。混合动力车可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1mol水蒸气放热569.1kJ。则该反应的热化学方程式为 。
(2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理如下图,其总反应式是:
H2+2NiOOH 2Ni(OH)2。
2Ni(OH)2。
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH将
(填“增大”、“不变”或“减小”),该电极的电极反应式为 ;在刹车和下坡时甲电极的电极反应为 。
(3)汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度:
(g)。已知:平衡时各物质的浓度关系有
已知:平衡时各物质的浓度关系有 ,K是一个只与温度有关的常数,称为化学平衡常数。
,K是一个只与温度有关的常数,称为化学平衡常数。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请填写表中的空格。
| 容器编 号 | c(CO)/ mol/L | c(O2)/ mol/L | c(CO2)/ mol/L | v(正)和v(逆)的比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)= v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | |
发展混合动力车是实施节能减排的重要措施之一。混合动力车可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1mol水蒸气放热569.1kJ。则该反应的热化学方程式为 。
(2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理如下图,其总反应式是:
H2+2NiOOH 2Ni(OH)2。
2Ni(OH)2。

根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH将
(填“增大”、“不变”或“减小”),该电极的电极反应式为 ;在刹车和下坡时甲电极的电极反应为 。
(3)汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度:
(g)。已知:平衡时各物质的浓度关系有
已知:平衡时各物质的浓度关系有 ,K是一个只与温度有关的常数,称为化学平衡常数。
,K是一个只与温度有关的常数,称为化学平衡常数。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请填写表中的空格。
|
容器编 号 |
c(CO)/ mol/L |
c(O2)/ mol/L |
c(CO2)/ mol/L |
v(正)和v(逆)的比较 |
|
Ⅰ |
2.0×10-4 |
4.0×10-4 |
4.0×10-2 |
v(正)= v(逆) |
|
Ⅱ |
3.0×10-4 |
4.0×10-4 |
5.0×10-2 |
|
②相同温度下,某汽车尾气中CO、CO2的浓度分别为1.0×10-5 mol/L和1.0×10-4mol/L。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×10-4mol/L,则最终尾气中CO的浓度为 。
发展混合动力车是实施节能减排的重要措施之一.混合动力车可以用电动机、内燃机或二者结合推动车轮.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1 mol水蒸气放热569.1 kJ.则该反应的热化学方程式为________.
(2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液.镍氢电池充放电原理如下图,其总反应式是:H2+2NiOOH![]() 2Ni(OH)2.
2Ni(OH)2.
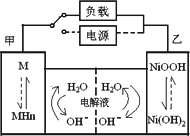
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH将________(填“增大”、“不变”或“减小”),该电极的电极反应式为________;在刹车和下坡时甲电极的电极反应式为________.
(3)汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度:
2CO(g)+O2(g)![]() 2CO2(g).已知:平衡时各物质的浓度关系有
2CO2(g).已知:平衡时各物质的浓度关系有
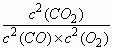 =K,K是一个只与温度有关的常数,称为化学平衡常数.
=K,K是一个只与温度有关的常数,称为化学平衡常数.
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示.请填写表中的空格.
②相同温度下,某汽车尾气中CO、CO2的浓度分别为1.0×10-5 mol/L和1.0×10-4 mol/L.若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×10-4 mol/L,则最终尾气中CO的浓度为________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com