
题目列表(包括答案和解析)
| 温度/℃ | 250 | 310 | 350 |
| K | 2.041 | 0.250 | 0.012 |
| 浓度mol/L 时间/min |
c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | 1.2 | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
甲醇汽油是由10%一25%的甲醇与其他化工原料、添加剂合成的新型车用燃料,可达到国标汽油的性能和指标。甲醇是一种可再生能源,具有广泛的开发和应用前景。
Ⅰ、工业上合成甲醇一般采用下列反应:CO(g)+2 H2(g) CH3 OH(g) △H=a
kJ/mol,
CH3 OH(g) △H=a
kJ/mol,
下表是该反应在不同温度下的化学平衡常数(K):
|
温度/0C |
250 |
310 |
350 |
|
K |
2.041 |
0.250 |
0.012 |
(1)由表中数据判断△H a 0(填“>”、“=”或“<”)。
(2)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.5 mol·L-1,则此时的温度为 0C。
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
|
浓度mol/L 时间/min |
c(CO) |
c(H2) |
c(CH3OH)
|
|
0 |
0.8 |
1.6 |
0 |
|
2 |
0.6 |
1.2 |
0.2 |
|
4 |
0.3 |
0.6 |
0.5 |
|
6 |
0.3 |
0.6 |
0.5 |
①反应从2 min到4 min之间,H2的反应速率为 。
②反应达到平衡时CO的转化率为 。
③反应在第2 min时改变了反应条件,改变的条件可能是 (填序号)。
A.使用催化剂 B.降低温度 C.增加H2的浓度
(4)向容积相同、温度分别为T1和T2的两个密闭容器中均充入1 molCO和2 mol H2,发生反应CO(g)+2 H2(g)  CH3 OH(g)△H=a kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则
CH3 OH(g)△H=a kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则
w1 w2(填序号)。
A.大于 B.小于 C.等于 D.以上都有可能
Ⅱ、甲醇在化学电源方面也有着重要应用。写出以甲醇为燃料,氢氧化钠溶液为电解质溶液的原电池中负极的电极反应式: 。
甲醇汽油是由10%一25%的甲醇与其他化工原料、添加剂合成的新型车用燃料,可达到国标汽油的性能和指标。甲醇是一种可再生能源,具有广泛的开发和应用前景。
Ⅰ、工业上合成甲醇一般采用下列反应:CO(g)+2 H2(g) CH3 OH(g) △H="a" kJ/mol,
CH3 OH(g) △H="a" kJ/mol,
下表是该反应在不同温度下的化学平衡常数(K):
| 温度/0C | 250 | 310 | 350 |
| K | 2.041 | 0.250 | 0.012 |
| 浓度mol/L 时间/min | c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | 1.2 | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
 CH3 OH(g)△H="a" kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则
CH3 OH(g)△H="a" kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则甲醇汽油是由10%-25%的甲醇与其他化工原料、添加剂合成的新型车用燃料,可达到国标汽油的性能和指标.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇一般采用下列反应:CO(g)+2H2(g)![]() CH3OH(g) △H=a kj/mol,
CH3OH(g) △H=a kj/mol,
下表是该反应在不同温度下的化学平衡常数(K):
(1)由表中数据判断ΔH a________0(填“>”、“=”或“<”).
(2)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.5 mol·L-1,则此时的温度为________℃.
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
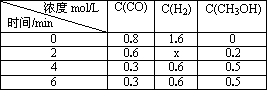
①反应从2 min到4 min之间,H2的反应速率为________.
②反应达到平衡时CO的转化率为________.
③反应在第2 min时改变了反应条件,改变的条件可能是________(填序号).
a.使用催化剂
b.降低温度
c.增加H2的浓度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com