
题目列表(包括答案和解析)
(12分)、
Ⅰ(4分)、下列实验操作及实验现象或结论正确的是_________________
A用粗盐提纯精盐,滤液在蒸发皿里加热蒸干,当有少量固体析出时即停止加热
B分液操作时,分液漏斗下层液体从下口放出,上层液体从上口倒出
C 某物质灼烧时,焰色反应为黄色,则说明该物质一定含钠元素,但不能确定该物质中一定没有钾元素
D 配制一定物质的量浓度的溶液时,将溶解在烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也要注入容量瓶
Ⅱ(8分)、如图在下衬白纸的玻璃片中央放置适量的KMnO4颗粒,在周围分别滴加溶液(如图所示),然后在KMnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿。提示:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(1)用双线桥标明电子转移的方向和数目,并指出氧化产物和还原产物
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 氧化产物________还原产物__________
(2)a处观察到的现象是_________________________
(3)b处出现了先变蓝后接着蓝色又褪去的现象,其中变蓝的原因是(用离子方程式表示)_________________________________________
(4)c处反应的化学方程式是_________________________________________
(5)d处反应的离子方程式______________________________________________,检验d试剂是否变质,可选用试剂__________________
(12分)、
Ⅰ(4分)、下列实验操作及实验现象或结论正确的是_________________
A用粗盐提纯精盐,滤液在蒸发皿里加热蒸干,当有少量固体析出时即停止加热
B分液操作时,分液漏斗下层液体从下口放出,上层液体从上口倒出
C 某物质灼烧时,焰色反应为黄色,则说明该物质一定含钠元素,但不能确定该物质中一定没有钾元素
D 配制一定物质的量浓度的溶液时,将溶解在烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也要注入容量瓶
Ⅱ(8分)、如图在下衬白纸的玻璃片中央放置适量的KMnO4颗粒,在周围分别滴加溶液(如图所示),然后在KMnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿。提示:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O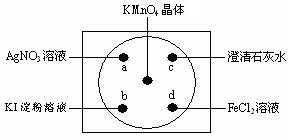
(1)用双线桥标明电子转移的方向和数目,并指出氧化产物和还原产物
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 氧化产物________还原产物__________
(2)a处观察到的现象是_________________________
(3)b处出现了先变蓝后接着蓝色又褪去的现象,其中变蓝的原因是(用离子方程式表示)_________________________________________
(4)c处反应的化学方程式是_________________________________________
(5)d处反应的离子方程式______________________________________________,检验d试剂是否变质,可选用试剂__________________
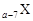 、
、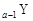 、
、 、
、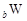 、
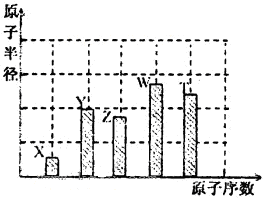
、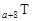 是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。
是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。
(l)W在周期表中的位置为_______________________。
(2)Y、Z的10电子氢化物分子中均含有的化学键类型为___________;其稳定性较强的是___________
(填化学式)。
(3)用化学方程式表示YZ2形成酸雨的反应:______________________。
用精密pH试纸(精确到0.l)测定酸雨pH的操作是______________________。
(4)常温下用1 mol/L100 mL NaOH溶液恰好完全吸收0.1molTZ2气体,此反应的离子方程式为
______________________;此时溶液pH<7的原因是___________________________。
(5)在25℃、101kPa下,己知W与X形成的气态化合物与足量Z2点燃完全反应(生成W的最高价
化合物),恢复至原状态,平均每转移l mol e_放热190 kJ,该反应的热化学方程式为___________。
(12分)、
Ⅰ(4分)、下列实验操作及实验现象或结论正确的是_________________
A用粗盐提纯精盐,滤液在蒸发皿里加热蒸干,当有少量固体析出时即停止加热
B分液操作时,分液漏斗下层液体从下口放出,上层液体从上口倒出
C 某物质灼烧时,焰色反应为黄色,则说明该物质一定含钠元素,但不能确定该物质中一定没有钾元素
D 配制一定物质的量浓度的溶液时,将溶解在烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也要注入容量瓶
Ⅱ(8分)、如图在下衬白纸的玻璃片中央放置适量的KMnO4颗粒,在周围分别滴加溶液(如图所示),然后在KMnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿。提示:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
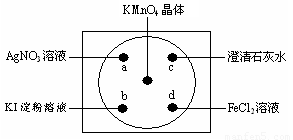
(1)用双线桥标明电子转移的方向和数目,并指出氧化产物和还原产物
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 氧化产物________还原产物__________
(2)a处观察到的现象是_________________________
(3)b处出现了先变蓝后接着蓝色又褪去的现象,其中变蓝的原因是(用离子方程式表示)_________________________________________
(4)c处反应的化学方程式是_________________________________________
(5)d处反应的离子方程式______________________________________________,检验d试剂是否变质,可选用试剂__________________
 、
、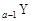 、
、 、
、 、
、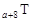 是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。
是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。
(l)W在周期表中的位置为_______________________。
(2)Y、Z的10电子氢化物分子中均含有的化学键类型为___________;其稳定性较强的是___________
(填化学式)。
(3)用化学方程式表示YZ2形成酸雨的反应:______________________。
用精密pH试纸(精确到0.l)测定酸雨pH的操作是______________________。
(4)常温下用1 mol/L100 mL NaOH溶液恰好完全吸收0.1molTZ2气体,此反应的离子方程式为
______________________;此时溶液pH<7的原因是___________________________。
(5)在25℃、101kPa下,己知W与X形成的气态化合物与足量Z2点燃完全反应(生成W的最高价
化合物),恢复至原状态,平均每转移l mol e_放热190 kJ,该反应的热化学方程式为___________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com