
题目列表(包括答案和解析)
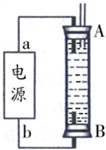 (2013?通州区二模)碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
(2013?通州区二模)碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
| 1 |
| 6 |
| 1 |
| 6 |
 (1)在298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水放出热量1558.3kJ.写出该反应的热化学方程式
(1)在298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水放出热量1558.3kJ.写出该反应的热化学方程式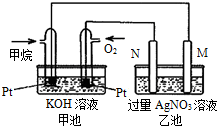 天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式如下,请回答下列问题:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6kJ/mol.
天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式如下,请回答下列问题:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6kJ/mol.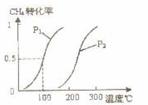 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇。
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇。
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) DH1
CO(g)+3H2(g) DH1
②CO(g)+2H2(g)![]() CH3OH(g) DH2
CH3OH(g) DH2
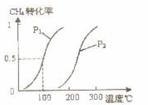
将0.20 mol CH4和0.30 mol H2O(g)通入容积为10 L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图。
⑴温度不变,缩小体积,①的逆反应速率 (填“增大”、“减小”或“不变”)。
⑵反应①的DH1 0(填“<”“=”或“>”)100°C时的平衡常数值K= 。
⑶在压强为0.1Mpa条件下,将amolCO与3amolH2的混合气体在催化剂作用下进行反应②再生成甲醇。为了发寻找合成甲醇的适宜的温度和压强,某同学设计了二组实验,部分实验条件已经填在下面实验设计表中。请在空格中填入剩余的实验条件数据。
| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
| I | 150 | 1/3 | 0.1 |
| II | 5 | ||
| III | 350 | 5 |
300°C时,其他条件不变,将容器的容积压缩到原来的1/2,对平衡体系产生的影响是(填字母)( )
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加 D.重新平衡时c(H2)/c(CH2OH)减小
⑷已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)DH=-1275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) DH=-556.0 kJ·mol-1
 ③H2O(g)=H2O(l)DH=-44.0 kJ·mol-1
③H2O(g)=H2O(l)DH=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳的液态水的热化学方程式 。
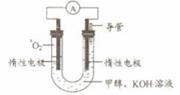
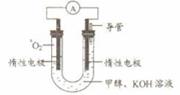
⑸某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
①该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇。
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇。
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) DH1
CO(g)+3H2(g) DH1
②CO(g)+2H2(g)![]() CH3OH(g) DH2
CH3OH(g) DH2
将0.20 mol CH4和0.30 mol H2O(g)通入容积为10 L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图。
⑴温度不变,缩小体积,①的逆反应速率 (填“增大”、“减小”或“不变”)。
⑵反应①的DH1 0(填“<”“=”或“>”)100°C时的平衡常数值K= 。
⑶在压强为0.1Mpa条件下,将amolCO与3amolH2的混合气体在催化剂作用下进行反应②再生成甲醇。为了发寻找合成甲醇的适宜的温度和压强,某同学设计了二组实验,部分实验条件已经填在下面实验设计表中。请在空格中填入剩余的实验条件数据。
| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
| I | 150 | 1/3 | 0.1 |
| II | 5 | ||
| III | 350 | 5 |
300°C时,其他条件不变,将容器的容积压缩到原来的1/2,对平衡体系产生的影响是(填字母)( )
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加 D.重新平衡时c(H2)/c(CH2OH)减小
⑷已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)DH=-1275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) DH=-556.0 kJ·mol-1
③H2O(g)=H2O(l)DH=-44.0 kJ·mol-1
 写出甲醇不完全燃烧生成一氧化碳的液态水的热化学方程式 。
写出甲醇不完全燃烧生成一氧化碳的液态水的热化学方程式 。
⑸某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
①该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
一、选择题(每小题只有一个选项符合题意,每小题3分,共48分)
题号
1
2
3
4
5
6
7
8
答案
C
A
C
A
B
A
D
D
题号
9
10
11
12
13
14
15
16
答案
B
B
C
D
A
C
B
D
二、填空题:(17题每空3分,第19(2)题3分,其它每空2分,共29分)
17.(CH3)C-CH=CH2 ;(CH3)
18.(1)C25H20 (2) 不 (3)3
.files/image021.gif)
.files/image022.gif) 19.(1)结构简式为 CH3
CH3
19.(1)结构简式为 CH3
CH3
Br ,
CH3
.files/image023.gif) |
CH3
(2)33
20.(1)C6H4S4 5?
(2)n+1-.files/image025.gif) (3)C8H8
(3)C8H8 .files/image026.gif)
三、实验题:( 第一小题3分,其它每小题2分,共13分)
21. (1)写出实验室制取硝基苯化学方程式:
。
(2)催化剂;脱水剂
(3)控制水溶液温度为
(4)试管受热均匀,便于控制温度 (5)使苯蒸气冷凝回流,减少挥发
(6)倒入水中,使用分液漏斗分离下层硝基苯.
四、推断题:( 每空2分,共10分)
五、计算题:(第(1)(2)小题各3分,第(3)小题4分,共10分)
(1)根据.files/image031.gif) →
→.files/image033.gif) 可知,1mol
可知,1mol .files/image031.gif) 生成5mol水,即
生成5mol水,即
(2)反应后和反应前的压强之比即为气体的物质的量之比,设反应消耗氧气的物质的量
为y,则.files/image035.gif) =0.557,y=6.18mol。
=0.557,y=6.18mol。
(3)燃烧后气体物质的量减少:(1+6.18―4)mol=3.18mol,设生成.files/image037.gif) 的丁烷为amol,
的丁烷为amol,
生成CO的丁烷为(1-a)mol,则有:
.files/image031.gif) +
+.files/image039.gif) →
→.files/image041.gif) +
+.files/image033.gif) n
n
1 6.5 4 3.5
a
.files/image043.gif) →4CO+
→4CO+.files/image033.gif) n
n
1 4.5 4 1.5
1-a 1.5(1-a)
由题意:
即丁烷有84%转化为.files/image037.gif) ,16%转化为CO,它们的物质的量分别为:
,16%转化为CO,它们的物质的量分别为:
n(.files/image037.gif) )=4mol×84%=3.36mol n(CO)=4mol×16%=0.64mol
)=4mol×84%=3.36mol n(CO)=4mol×16%=0.64mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com