
题目列表(包括答案和解析)
取0.2mol·L-1HX溶液与0.2mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8(25oC),则下列说法(或关系式)正确的是( )
A.混合溶液中由水电离出的c(OH-)=1×10-8mol·L-1
B.c(Na+)=c(X-)+c(HX)=0.2mol·L-1
C.c(Na+)-c(X-)=9.9×10-7mol·L-1
D.c(OH-)-c(HX)=c(H+)=1×10-6mol·L-1
取0.2mol·L-1HX溶液与0.2mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8(25oC),则下列说法(或关系式)正确的是( )
A.混合溶液中由水电离出的c(OH-)=1×10-8mol·L-1
B.c(Na+)=c(X-)+c(HX)=0.2mol·L-1
C.c(Na+)-c(X-)=9.9×10-7mol·L-1
D.c(OH-)-c(HX)=c(H+)=1×10-6mol·L-1
室温下,将1.00mol· L-1盐酸滴入20.00mL1.00mol· L-1氨水中,溶液pH随加入盐
酸体积变化曲线如图所示。下列有关说法正确的是
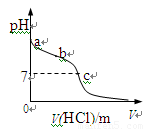
A.a点:pH=14
B.b点:c(NH4+) +c(NH3·H2O) = c(Cl-)
C.c点:水电离出的c(H+) = 1.0×10-7mol· L-1
D.c点后,溶液中离子浓度大小关系一定为:
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
①t℃时,测得纯水中c(OH-)=2×10-7mol·L-1,则t(填“>”、“<”或“=”)________25℃,该温度下,水的离子积常数为________;
②25℃时,某K2SO4溶液中c(SO42-)=1×10-4mol·L-1,取该溶液1mL加水稀释至100mL,则稀释后的溶液中c(K+):c(H+)=________;
在100℃时,水的离子积为1×10-12,若该温度下某溶液中C(H+)=1×10-7mol/L,则该溶液
[ ]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com