
题目列表(包括答案和解析)
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于 。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2+6H2O  C6H12O6+6O2 b .CO2+3H2?
C6H12O6+6O2 b .CO2+3H2?  CH3OH+H2O
CH3OH+H2O
c.CO2+CH4  CH3COOH d. 2CO2+6H2
CH3COOH d. 2CO2+6H2  CH2==CH2+4H2O
CH2==CH2+4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。
(3)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:
在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CH3OH(g)+H2O(g)△H=-49.0kJ/mol
|
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)
②该反应的平衡常数表达式为 ,升高温度,平衡常数的数值将
(填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 .
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH2
(4)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) ![]() 2NH3(g) △H=-93.4kJ/mol
2NH3(g) △H=-93.4kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
|
图t1时引起平衡移动的条件可能是 。
其中表示平衡混合物中NH3含量最高的一段时间是 。
②温度为T°C时,将3amolH2和amolN2放入带有活塞的密闭容器中,如果活塞能自由移动,充分反应后测得N2的转化率为50%。如果在相同温度下将3amolH2、amolN2和2amolNH3气体放入该容器中,平衡时H2的转化率为 。
请认真分析苯酚与甲醛反应形成酚醛树脂的反应原理,并回答下面的问题。
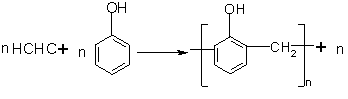
H2O
(1)上述方程式表示的是线型酚醛树脂的合成过程,为保证得到线型酚醛树脂,实验中往往要用过量的苯酚,这样得到的树脂呈现粉红色。其原因是
。
线型酚醛树脂属于热塑性的树脂,受热可以变形。若把上述线型树脂再与过量甲醛及催化剂混合,置于模具中加热,则酚醛树脂可转化为体型(网状结构)的热固性高分子。请结合你已有的知识,猜测线型酚醛树脂转化为体形结构的原理。 。
(2)若用苯酚和乙醛在一定条件下反应,也可以得到一种线型的酚醛树脂,试写出该反应的化学方程式: 。
(3)尿醛塑料也是一类有广泛用途的合成树脂。有一种尿醛树脂的结构简式为:
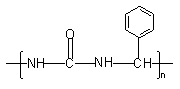
该树脂的单体是 和 ,写出该合成反应的化学方程式(不必写反应条件): 。
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
|
已知:① NaFeO2遇水强烈水解。
② Cr2O72-+ H2O ![]() 2CrO42- + 2H+
2CrO42- + 2H+
请回答:
(1)生成滤渣1中红褐色物质的反应的化学方程式是 。
滤液1的成分除Na2CrO4外,还含有(填化学式) 。
(2)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是 。
(3)由滤液2转化为Na2Cr2O7溶液应采取的措施是 。
(4)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、 、 、洗涤、干燥。
(5)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是
。
“84消毒液”与硫酸溶液反应可以制取氯气(NaClO+ NaCl+H2SO4 = Na2SO4 + Cl2↑+H2O)
为探究氯气的性质,某同学设计了如下所示的实验装置
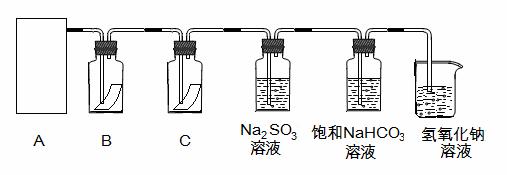 |
请回答:
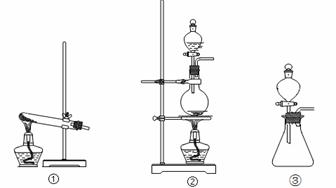
(1)从①、②、③装置中选择合适的制气装置(A处) (填写序号)。
(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是 ,说明该装置存在明显的缺陷,请提出合理的改进的方法 。
(3)为了验证氯气的氧化性,将氯气通Na2SO3溶液中,写出氯气与Na2SO3溶液反应的离子方程式 。
(4)氯气通入饱和NaHCO3溶液能产生无色气体,已知酸性盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有 。
(5)写出氯气与氢氧化钠溶液反应的化学方程式 ,为验证尾气吸收后的溶液中存在氯离子,正确的操作为 。
选项 试剂C A离子 B离子
A HCl、BaCl2 SO42- SO32-
B AgNO3 Cl- I-
C KSCN Fe2+ Fe3+
D NH3·H2O Al3+ Ag+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com