
题目列表(包括答案和解析)
磷在自然界常以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物有着广泛的应用。
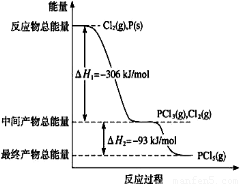
(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
请回答问题:
①PCl5分解成PCl3和Cl2的热化学方程式是???????? ?????????????????????? ???? 。
②P和Cl2分两步反应生成1 mol PCl5的△H3=???? 。
(2)PCl5分解成PCl3和Cl2的反应是可逆反应。T℃时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,经过250 s达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | 50 | 150 | 250 | 350 |
n(PCl3) / mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
①反应在50~150s 内的平均速率v(PCl3)=???????????? 。
②试计算该温度下反应的平衡常数(写出计算过程,保留2位有效数字)
(3)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示。
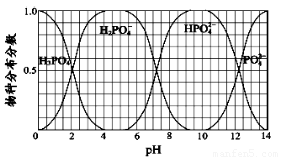
①为获得较纯的Na2HPO4,pH应控制在?????? ;pH=6时,溶液中主要含磷物种浓度大小关系为:??????? ????????????????????????????????????? ??? 。
②Na2HPO4溶液呈碱性,加入足量的CaCl2溶液,溶液显酸性,溶液显酸性的原因是(从离子平衡角度分析)???????????????????????????????????????????????????????? ?????? 。
磷在自然界常以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物有着广泛的应用。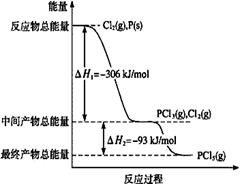
(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
请回答问题:
①PCl5分解成PCl3和Cl2的热化学方程式是 。
②P和Cl2分两步反应生成1 mol PCl5的△H3= 。
(2)PCl5分解成PCl3和Cl2的反应是可逆反应。T℃时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,经过250 s达到平衡。反应过程中测定的部分数据见下表:
| t / s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3) / mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| |||||||||||||||||||||||||||||
以节能减排为基础的低碳经济已成为实现人类可持续发展的重要课题。
(1)控制和治理CO2是解决温室效应的有效途径,其中一种途径是将CO2转化成有机物实现碳循环。如2CO2(g)+2H2O(1) C2H4(g)+3O2(g)△H=+1411.0kJ/mol
2CO2(g)+3H2O(1) C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
则由C2H5OH(1)转化为C2H4(g)和H2O(1)的热化学方程式为 。
(2)为探究反应6H2(g)+2CO2(g)![]() CH3CH2OH(g)+3H2O(g)发生的适宜条件,现改变氢碳比[n(H2)/n(CO2)]和温度等条件进行了如下实验:
CH3CH2OH(g)+3H2O(g)发生的适宜条件,现改变氢碳比[n(H2)/n(CO2)]和温度等条件进行了如下实验:
根据表中实验数据分析:
①该反应的正反应为 (填“吸热”或“放热”)反应。
②为提高CO2的平衡转化率,可采取的措施有 (写出一条即可)。
(3)一定条件下,将3 mol H2 和1mol CO2气态混合物充入2L 密闭容器中,发生如下反应:3H2(g)+CO2(g)![]() CH3OH(g)+H2O(g)。2min时该反应达到平衡,测得CH3OH的物质的量浓度为0.2mol/L。下列说法正确的是 。
CH3OH(g)+H2O(g)。2min时该反应达到平衡,测得CH3OH的物质的量浓度为0.2mol/L。下列说法正确的是 。
A.该反应的平衡常数表达式为![]()
B.CO2的平衡转化率为40%
C.2min内H2的平均反应速率为0.3mol/(L·min)
D.该反应达到平衡状态的标志是混合气体的密度不发生改变
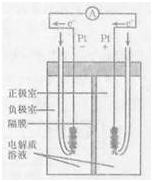
(4)右图是甲烷燃料电池的工作原理示意图,电解质溶液为KOH溶液。则负极室通入的气体是 (填“甲烷”或“氧气”);正极室电极上发生的电极反应是 ;其电池的总反应为 。比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是能量转化效率高,其次是 。
以节能减排为基础的低碳经济已成为实现人类可持续发展的重要课题。
(1)控制和治理CO2是解决温室效应的有效途径,其中一种途径是将CO2转化成有机物实现碳循环。如2CO2(g)+2H2O(1) C2H4(g)+3O2(g)△H=+1411.0kJ/mol
2CO2(g)+3H2O(1) C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
则由C2H5OH(1)转化为C2H4(g)和H2O(1)的热化学方程式为 。
(2)为探究反应6H2(g)+2CO2(g)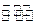 CH3CH2OH(g)+3H2O(g)发生的适宜条件,现改变氢碳比[n(H2)/n(CO2)]和温度等条件进行了如下实验:
CH3CH2OH(g)+3H2O(g)发生的适宜条件,现改变氢碳比[n(H2)/n(CO2)]和温度等条件进行了如下实验: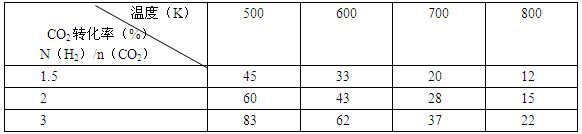
根据表中实验数据分析:
①该反应的正反应为 (填“吸热”或“放热”)反应。
②为提高CO2的平衡转化率,可采取的措施有 (写出一条即可)。
(3)一定条件下,将3 mol H2和1mol CO2气态混合物充入2L密闭容器中,发生如下反应:3H2(g)+CO2(g)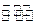 CH3OH(g)+H2O(g)。2min时该反应达到平衡,测得CH3OH的物质的量浓度为0.2mol/L。下列说法正确的是 。
CH3OH(g)+H2O(g)。2min时该反应达到平衡,测得CH3OH的物质的量浓度为0.2mol/L。下列说法正确的是 。
A.该反应的平衡常数表达式为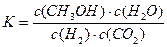 |
| B.CO2的平衡转化率为40% |
| C.2min内H2的平均反应速率为0.3mol/(L·min) |
| D.该反应达到平衡状态的标志是混合气体的密度不发生改变 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com