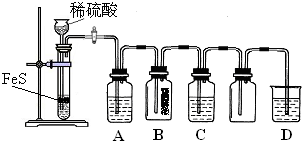
(2011?武汉模拟)某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2gCuSO
4?5H
2O研细后倒入烧杯,加10mL蒸馏水溶解;
②向上述CuSO
4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用.
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是
①②③
①②③
(填实验序号),步骤①、③中研磨固体所用仪器的名称是
研钵
研钵
;
(2)步骤③中洗涤沉淀的操作是
沿玻璃棒向漏斗中沉淀加蒸馏水至浸没沉淀,待水自然流出后,重复2-3次,
沿玻璃棒向漏斗中沉淀加蒸馏水至浸没沉淀,待水自然流出后,重复2-3次,
.
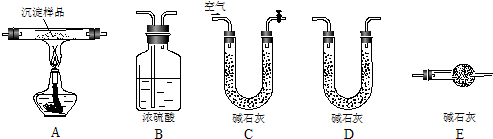
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较,用右图装置进行实验,实验时均以生成25mL气体为准,其它可能影响实验的因素均已忽略,相关数据见表:
| 实验序号 |
KClO3质量 |
其它物质质量 |
待测数据 |
| ④ |
1.2g |
无其他物质 |
|
| ⑤ |
1.2g |
CuO 0.5g |
|
| ⑥ |
1.2g |
MnO2 0.5g |
|
回答下列问题:
(3)上述实验中的“待测数据”指
产生25mL气体所需时间
产生25mL气体所需时间
;
(4)本实验装置图中量气装置B由干燥管、乳胶管和50mL滴定管改造后组装而成,此处所用滴定管是
碱式
碱式
(填“酸式”或“碱式”)滴定管;
(5)若要证明实验⑤中干燥管内收集的气体是O
2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,
用带火星的木条靠近,若复燃则证明收集的气体是氧气.
用带火星的木条靠近,若复燃则证明收集的气体是氧气.
;
(6)为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a.
检测CuO反应前后质量是否改变
检测CuO反应前后质量是否改变
,b.CuO的化学性质有没有改变.

 (2011?武汉模拟)某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(2011?武汉模拟)某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验: