
题目列表(包括答案和解析)
镁是很活泼的金属,常用做脱硫剂,脱氧剂。在电子工艺中利用镁制取硅的反应为:2Mg+ SiO2![]() 2MgO+Si,△H=-372kJ•mol-1,同时有副反应:2Mg+Si
2MgO+Si,△H=-372kJ•mol-1,同时有副反应:2Mg+Si![]() Mg2Si发生。Mg2Si遇盐酸迅速反应生成硅烷(SiH4),SiH4常温下是一种不稳定,易分解的气体。
Mg2Si发生。Mg2Si遇盐酸迅速反应生成硅烷(SiH4),SiH4常温下是一种不稳定,易分解的气体。

甲 乙
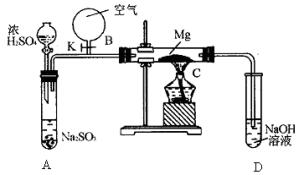
(1)如图甲所示是进行Mg与SiO2反应的实验装置。
①由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气。X气体应为________(镇标号)。
A.H2 B.N2 C.CO2
②实验开始时必须先通入X气体后,再接通电源加热反应物,其理由是________,当反应引发后,切断电源,反应能继续进行,其理由是________
③反应结束后,待冷却至常温后,关闭K,从分液漏斗处加稀盐酸,可观察到导管口A处有闪亮的火星,据此可推知SiH4的性质________。
(2)用图乙所示装置的实验如下:先关闭K,使A中反应进行,加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质。实验完成后将C管中固体全部加入盐酸中,有腐蛋味气体生成。
①C中Mg应放在不锈钢垫片上,而不能直接接触试管壁,这是因为________。
②停止实验时,先打开K,再停止滴加浓H2SO4,最后熄灭酒精灯。橡胶气胆B在实验中的作用是________。
③C中全部产物有________(填化学式)。


甲 乙
(1)如图甲所示是进行Mg与SiO2反应的实验装置。
①由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气。X气体应为________(镇标号)。
A.H2 B.N2 C.CO2
②实验开始时必须先通入X气体后,再接通电源加热反应物,其理由是________,当反应引发后,切断电源,反应能继续进行,其理由是________
③反应结束后,待冷却至常温后,关闭K,从分液漏斗处加稀盐酸,可观察到导管口A处有闪亮的火星,据此可推知SiH4的性质________。
(2)用图乙所示装置的实验如下:先关闭K,使A中反应进行,加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质。实验完成后将C管中固体全部加入盐酸中,有腐蛋味气体生成。
①C中Mg应放在不锈钢垫片上,而不能直接接触试管壁,这是因为________。
②停止实验时,先打开K,再停止滴加浓H2SO4,最后熄灭酒精灯。橡胶气胆B在实验中的作用是________。
③C中全部产物有________(填化学式)。
中学化学中氢元素常常在化合物中显+1价,但氢是非金属元素,是否也有负价呢?科学家经过研究,已合成了氢化钾、氢化钠等碱金属氢化物,其反应为:2K+H2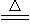 2KH。已知KH为白色固体,极易与水反应:KH+H2O=KOH+H2↑。某研究学习小组设计了下列三套方案:
2KH。已知KH为白色固体,极易与水反应:KH+H2O=KOH+H2↑。某研究学习小组设计了下列三套方案: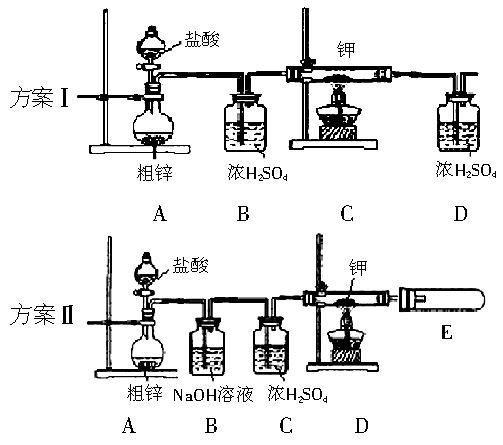
(1)请你评价三套实验方案,找出每套方案的优缺点,填入下表: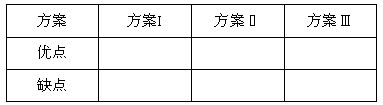
(2)请你设计一套合理方案,根据合理方案进行实验,其步骤如下:
A.检验装置气密性;B.装药品;C.停止加热;D.打开分液漏斗;E.通一会儿气体;F.收集并检验气体纯度;G.关闭分液漏斗活塞;H.加热
①正确的操作顺序是_________(填序号,同一操作可重复使用);②检验气体纯度的目的是_________;③从安全角度考虑,尾气的正确处理方法是_________
____________。
(3)根据制备氢和钾的化合物KH已成为事实,请你推测氢元素具备下列元素某些性质的是_________,理由是_________。
A.碳 B.氧 C.钠 D.氯 E.镁
 有A、B、C、D、E五种短周期元素,它们的原子序数由A到E依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物.D为原子核内有12个中子的二价金属,当2.4克D与盐酸反应时,在标准状况下放出气体2.24L.
有A、B、C、D、E五种短周期元素,它们的原子序数由A到E依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物.D为原子核内有12个中子的二价金属,当2.4克D与盐酸反应时,在标准状况下放出气体2.24L.

考生注意:此题为分叉题,分A、B两题,考生可任选一题。若两题均做,一律按A题计分。A题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。
(A)四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
| 元素 | A | B | C | D. |
| 性质或结构信息 | 室温下单质呈粉末状固体,加热易熔化。 单质在氧气中燃烧,发出明亮的蓝紫色火焰。 | 单质常温、常压下是气体,能溶于水。 原子的M层上有1个未成对的p电子。 | 单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 | 原子最外电子层上s电子数等于p电子数 单质为空间网状晶体,具有很高的熔、沸点。 |
(1)B元素在周期表中的位置是____________,写出A原子的电子排布式____________。
(2)写出C单质与水反应的化学方程式_____________________。A与C形成的化合物溶于水后,溶液的pH____________7(填“大于”“等于”或“小于”)。
(3)D元素最高价氧化物晶体的硬度__________(填“大”或“小”),其理由是____________________________________________________________________。
(4)A、B两元素非金属性较强的是(写元素符号)______________。写出能证明这一结论的一个实验事实________________________________________________________________。
(B)元素A―D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
| 元素 | A | B | C | D |
| 性质或结构信息 | 单质制成的高压灯,发出的黄光透雾力强、射程远 | 工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构。 | 单质常温、常压下是气体,原子的L层有一个未成对的p电子 | +2价阳离子的核外电子排布与氖原子相同 |
(1)上表中与A属于同一周期的元素是___________,写出D离子的电子排布式___________。
(2)D和C形成的化合物属于_______________晶体。
写出C单质与水反应的化学方程式_____________________________________________。
(3)对元素B的单质或化合物描述正确的是_______________。
a.B元素的最高正价为+6
b.常温、常压下单质难溶于水
c.单质分子中含有18个电子
d.在一定条件下镁条能与单质B反应
(4)A和D两元素金属性较强的是___________(写元素符号)。写出能证明该结论的一个实验事实__________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com