
题目列表(包括答案和解析)
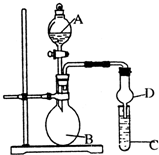 已知氢氧化铝既能与强酸反应,也能与强碱反应,但不能与弱酸和弱碱反应.某研究小组利用如图所示装置验证氢氧化铝的上述某些性质(试管C中盛有含铝元素的盐溶液),回答下列问题:
已知氢氧化铝既能与强酸反应,也能与强碱反应,但不能与弱酸和弱碱反应.某研究小组利用如图所示装置验证氢氧化铝的上述某些性质(试管C中盛有含铝元素的盐溶液),回答下列问题:| A | |||||||||||||||||
| B | C | D | E | F | |||||||||||||
| G | H | I | J | ||||||||||||||
| K | M | L |





已知氢氧化铝既能与强酸反应,也能与强碱反应,但不能与弱酸和弱碱反应.某研究小组利用如图所示装置验证氢氧化铝的上述某些性质(试管C中盛有含铝元素的盐溶液),回答下列问题:
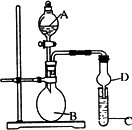
(1)图中D装置在实验中的作用是________.
(2)验证氢氧化铝能与强酸反应:
若B中的试剂为浓盐酸,C中试剂为Na[Al(OH)4]溶液,则A中的试剂为________,C中的现象为________.
(3)验证氢氧化铝不能与弱碱反应:若A中的试剂为浓氨水,则B中试剂为________,C中试剂为________,C中发生的离子反应方程式为________.
(4)验证氢氧化铝不能与弱酸反应:C中试剂为________,B中可能发生的化学反应方程式为________.
N和S是中学化学中重要的非金属元素,回答下列问题:
(1)实验室中用Cu分别和浓硫酸、浓硝酸反应制取并收集SO2、NO2,两者都需要下列仪器中的__________(填编号)

(2)向含1molNaOH的溶液中通入1molSO2恰好完全反应,生成的盐为___________,此时的溶液呈酸性,其原因是__________________________________________。
(3)液氨的某些性质与水相似。已知水分子自身能发生自偶电离,生成的阴、阳离子均含有10个电子。写出液氨分子发生自偶电离的方程式____________________;
液氨与Na反应的化学方程式为 。
(4)用水稀释0.1 mol·L-1氨水时,随着水量的增加而不变的是_______(填序号)
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(5)若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则每生成1mol N2的同时,生成 mol SO2。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com