
题目列表(包括答案和解析)
一定温度下,在容积为2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示,请回答下列问题:
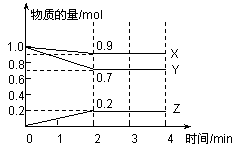
(1)该反应的化学方程式为 。
(2)反应开始至2min时,Z的平均反应速率为 。
(3)在3min时,改变某一外界条件,结果X、Y、Z的物质的量均不发生变化,则反应条件的变化可能是 (填序号)。
A.升高温度 B.增大压强 C.充入1mol氩气 D.使用催化剂
(4)4min时,在其他条件不变时,将容器的温度升高20℃,结果发现一段时间后,X的物质的量变为0.95mol,则下列说法正确的是 (填序号)。
A.生成Z的反应是吸热反应 B.正反应速率增大,逆反应速率减小
C.X的转化率增大 D.混合气体的平均相对分子质量减小
(5)若温度不变,将各为2mol的X、Y混合于容积为4L的密闭容器中,则达到平衡时,Z气体的物质的量为 ,X的转化率为 。
 I.在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,
I.在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中, 2X
2X 2X
2X 2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是
2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是
 2SO3 的两个素材:
2SO3 的两个素材:

 2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是______.
2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是______.
 2SO3 的两个素材:
2SO3 的两个素材:


(12分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g)![]() 3NH3(g)△H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用碳在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
3NH3(g)△H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用碳在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
(1)将水蒸气通过红热的炭即产生水煤气:
C(s) + H2O(g) H2(g) +CO(g) △H = +131.3 kJ ,△S = +133.7 J/K
该反应在低温下能否自发 (填:能或否)。
(2)合成氨工业中原料气压缩到30~50MPa的原因是 。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是 。
(3)已知在400℃时,N2 (g)+ 3H2(g) 2NH3(g) 的K=0.5。
①在400℃时, 2NH3(g)N2 (g)+ 3H2(g)的K= (填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。
③500℃、50MPa时,在容积为2L的容器中加入1 mol N2、3 mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K= 。
④在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号)。
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能:1>2
(12分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g) 3NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用碳在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
3NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用碳在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
(1)将水蒸气通过红热的炭即产生水煤气:
C(s) + H2O(g)  H2(g) + CO(g) △H =" +131.3" kJ ,△S =" +133.7" J/K
H2(g) + CO(g) △H =" +131.3" kJ ,△S =" +133.7" J/K
该反应在低温下能否自发 (填:能或否)。
(2)合成氨工业中原料气压缩到30~50MPa的原因是 。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是 。
(3)已知在400℃时,N2 (g)+ 3H2(g) 2NH3(g) 的K=0.5。
2NH3(g) 的K=0.5。
①在400℃时, 2NH3(g) N2 (g)+ 3H2(g)的K= (填数值)。
N2 (g)+ 3H2(g)的K= (填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。
③500℃、50MPa时,在容积为2L的容器中加入1 mol N2、3mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K= 。
④在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号)。
| A.图Ⅰ可能是不同压强对反应的影响,且P2>P1 |
| B.图Ⅱ可能是不同压强对反应的影响,且P1>P2 |
| C.图Ⅲ可能是不同温度对反应的影响,且T1>T2 |
| D.图Ⅱ可能是同温同压下,催化剂性能:1>2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com