
题目列表(包括答案和解析)
(10分)工业上综合利用黄铜矿(CuFeS2)制备净水剂高铁酸钠(Na2FeO4)、铜及其化合物的工业流程如下图所示:
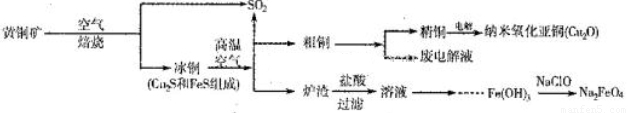
(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
(2)利用炉渣(含Fe2O3、FeO、SiO2、Al2O3)制备高铁酸钠的方法为:
①用稀盐酸浸取炉渣,过滤;
②向滤液中加入足量H2O2溶液,再加入足量NaOH溶液,过滤,将沉淀洗涤、于燥得Fe(0H)3;
③Fe(OH)3与NaClO和NaOH反应,生成高铁酸钠。
a.写出制取高铁酸钠的化学方程式:______________________;
b.验证炉渣中含有FeO必要的化学试剂为________________________。
(3)制备纳米氧化亚铜(Cu2O)时用铜棒和石墨做电极,饱和食盐水做电解质,电解反应为2Cu+H2O Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
|
n(SO32-):n(HSO3-) |
91:9 |
1:1 |
1:91 |
|
pH(25℃) |
8.2 |
7.2 |
6.2 |
当吸收液呈中性时,溶液中离子浓度由大到小的顺序为是________________。
(10分)工业上综合利用黄铜矿(CuFeS2)制备净水剂高铁酸钠(Na2FeO4)、铜及其化合物的工业流程如下图所示:
(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
(2)利用炉渣(含Fe2O3、FeO、SiO2、Al2O3)制备高铁酸钠的方法为:
①用稀盐酸浸取炉渣,过滤;
②向滤液中加入足量H2O2溶液,再加入足量NaOH溶液,过滤,将沉淀洗涤、于燥得Fe(0H)3;
③Fe(OH)3与NaClO和NaOH反应,生成高铁酸钠。
a.写出制取高铁酸钠的化学方程式:______________________;
b.验证炉渣中含有FeO必要的化学试剂为________________________。
(3)制备纳米氧化亚铜(Cu2O)时用铜棒和石墨做电极,饱和食盐水做电解质,电解反应为2Cu+H2O Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |
饮用水质量是关系人类健康的重要问题。
(1)氯气是最早用于饮用水消毒的物质,其消毒作用主要是氯气溶于水后生成了次氯酸,该反应的离子方程式为____________,所生成的次氯酸的电子式为____________。
(2)写出工业上制取漂白粉的化学反应方程式:____________。
(3)ClO2被称为“第四代”饮用水杀虫剂,因其高效率,无污染而被广泛使用。制备ClO2是发达国家普遍重视的课题,我国北京永利科技有限公司已用电解法批量生产ClO2。其反应原理为:4ClO![]() +4H+===4ClO2+O2↑+2H2O,试写出两电极反应式,阳极:____________;阴极:____________。
+4H+===4ClO2+O2↑+2H2O,试写出两电极反应式,阳极:____________;阴极:____________。
(4)相同物质的量的氯气与二氧化氯消毒时转移电子数目之比是____________。
(5)采用氧的一种同素异形体给自来水消毒,既提高了消毒效率、安全无副作用,又因为该物质在自然界中存在,对地球生命体起保护伞作用,该物质和氯气溶于水以及SO2的漂白原理分别是____________;____________。若将氯气与SO2二者混合,若想使石蕊试液褪色则![]() 范围为____________。
范围为____________。
饮用水质量是关系人类健康的重要问题。
(1)氯气是最早用于饮用水消毒的物质,其消毒作用主要是氯气溶于水后生成了次氯酸,该反应的离子方程式为____________,所生成的次氯酸的电子式为:____________。
(2)写出工业上制取漂白粉的化学反应方程式:____________________________。
(3)ClO2被称为“第四代”饮用水杀虫剂,因其高效率,无污染而被广泛使用.制备ClO2是发达国家普遍重视的课题,我国北京永利科技有限公司已用电解法批量生产ClO2。其反应原理为:4ClO 3―+4H+=4 ClO2+O 2↑+2H 2O 试写出两电极反应式:
阴极:_______________________________________________________
阳极:_______________________________________________________
(4)相同物质的量的氯气与二氧化氯消毒时转移电子数目之比是__________________
(5)采用氧的一种同素异形体用于自来水消毒,既提高了消毒效率,安全无副作用,该物质在自然界中存在,对地球生命体起保护伞作用。该物质和氯气溶于水以及SO2的漂白原理分别是_____________,____________________,__________________;若将氯气与SO2二者混合,若想使石蕊试液褪色则![]() 范围为____________。
范围为____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com