
题目列表(包括答案和解析)
要准确掌握化学用语及常用计量方法。按要求回答下列问题:
(1)NA表示阿伏加德罗常数。28g乙烯和环丁烷(C4H8)的混合气体中含有____NA个碳原子;分子总数为NA个的NO2和CO2混合气体含______ NA个氧原子数;1mol37Cl中,中子数比质子数多_______ NA个;1L 1mol/LFe2(SO4)3溶液中含_____NA个SO42-离子。
(2)图中A、B分别是某微粒的结构示意图,回答下列问题:

①若A表示某元素的原子,则y= 。
②若B表示某稀有气体元素的原子,则该元素的单质的化学式为 ,若B是阴离子的结构示意图,则x的取值范围是________________。
(3)RxO42-中R的化合价为___________(用含x 的式子表示),当0.3 mol RxO42-完全反应,生成RO2时,转移0.6 mol电子,则x=__________。
(4)将7.8 g镁铝合金与100mL 稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐46.2 g,则原硫酸的物质的量浓度为______________。
要准确掌握化学用语及常用计量方法。按要求回答下列问题:
(1)NA表示阿伏加德罗常数。28g乙烯和环丁烷(C4H8)的混合气体中含有____NA个碳原子;分子总数为NA个的NO2和CO2混合气体含______ NA个氧原子数;1mol37Cl中,中子数比质子数多_______ NA个;1L 1mol/LFe2(SO4)3溶液中含_____NA个SO42-离子。
(2)图中A、B分别是某微粒的结构示意图,回答下列问题: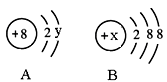
①若A表示某元素的原子,则y= 。
②若B表示某稀有气体元素的原子,则该元素的单质的化学式为 ,若B是阴离子的结构示意图,则x的取值范围是________________。
(3)RxO42-中R的化合价为___________(用含x 的式子表示),当0.3 mol RxO42-完全反应,生成RO2时,转移0.6 mol电子,则x=__________。
(4)将7.8 g镁铝合金与100mL 稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐46.2 g,则原硫酸的物质的量浓度为______________。
(12分)Ⅰ.从下列各组反应对比,判断哪种微粒的氧化性最强。
(1)在氯气中Fe锈蚀成棕褐色物质FeCl3,而在盐酸中生成淡绿色溶液FeCl2。则氯气分子、氢离子、氯离子中,__________具有氧化性,__________氧化性最强。请书写出以上各反应的化学方程式___________________________。
(2)已知在ⅣA族元素中,Pb2+和Sn4+的化合物较为稳定。
据此可判断PbO2具有较强的________性,SnCl2具有较强的________性;写出PbO2溶于盐酸的离子方程式____________________;写出SnCl2和FeCl3溶液混合的离子方程式_______________________________________
Ⅱ.氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40°C~50°C时反应可生成它。CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是:2Cu+===Cu2++Cu。
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作________(填“氧化剂”或“还原剂”)。
(2)写出CuH在氯气中燃烧的化学反应方程式:________________。
(3)CuH溶解在稀盐酸中生成的气体是____________(填化学式)。
(4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式: ______________________________。
(12分)Ⅰ.从下列各组反应对比,判断哪种微粒的氧化性最强。
(1)在氯气中Fe锈蚀成棕褐色物质FeCl3,而在盐酸中生成淡绿色溶液FeCl2。则氯气分子、氢离子、氯离子中,__________具有氧化性,__________氧化性最强。请书写出以上各反应的化学方程式___________________________。
(2)已知在ⅣA族元素中,Pb2+和Sn4+的化合物较为稳定。
据此可判断PbO2具有较强的________性,SnCl2具有较强的________性;写出PbO2溶于盐酸的离子方程式____________________;写出SnCl2和FeCl3溶液混合的离子方程式_______________________________________
Ⅱ.氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40°C~50°C时反应可生成它。CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是:2Cu+===Cu2++Cu。
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作________(填“氧化剂”或“还原剂”)。
(2)写出CuH在氯气中燃烧的化学反应方程式:________________。
(3)CuH溶解在稀盐酸中生成的气体是____________(填化学式)。
(4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式: ______________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com