
题目列表(包括答案和解析)

| 高温 |
| △ |
| 高温 |
| △ |
| ||
| ||
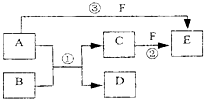 A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),
A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),
| ||
| △ |
| ||
| △ |
(8分)某学习小组用下图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
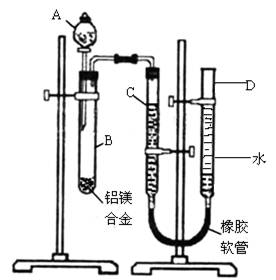
(提示:镁、铝均与酸反应,铝还能和碱反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑)
实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是除去铝镁合金表面的氧化膜。
(1)A中试剂为 .
(填“NaOH溶液”或“稀盐酸”)
(2)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录
C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温;④由A向B中滴加足量试剂;⑤检查气密性;⑥调整橡胶软管使D和C的液面相平。
上述操作的顺序是 ;(填序号)
(3)B中发生反应的离子方程式为 .
(4)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将 .
(填“偏大”、“偏小”、“不受影响”)
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b ml(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为 .(用含a、b、c的代数式表示)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com