
题目列表(包括答案和解析)

| ||
| ||
| ||

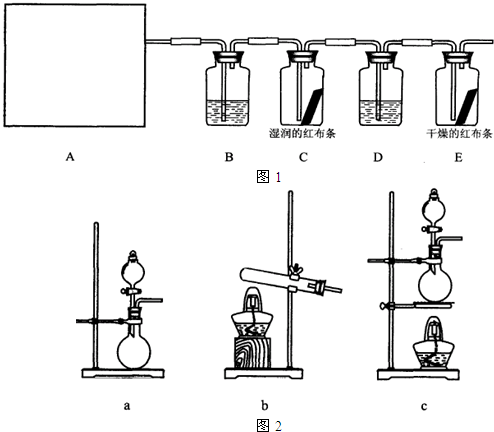
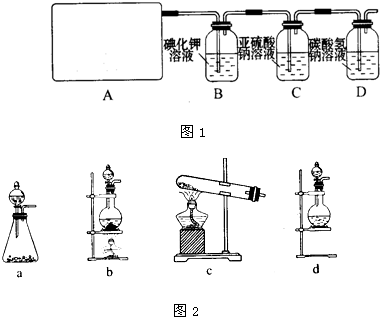
他们设计如下制取氯气并验证其性质的实验:

选用_________装置(填写装置的序号)制取氯气。

(2)请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已部分被氧化(简述实验步骤):
____________________________________________________________________
(3)写出在D装置中发生反应的离子方程式:______________________________________
(4)该实验存在明显的缺陷,请你提出改进的方法。
____________________________________________________________________
(5)该小组又进行了如下实验:称取漂白粉
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com