
题目列表(包括答案和解析)
有 A、B、C三种短周期元素。A-离子的电子层结构和氖原子相同;短周期元素中B的金属性最强;C的原子核内质子数是B的次外层电子数的2倍。试推断:
⑴.这三种元素分别是:A______、B______、C______;(用元素符号表示)
⑵. A的氢化物分子的电子式是__________;
⑶.C元素的最高价氧化物与足量NaOH溶液反应的离子方程式为___________。
【解析】考查原子核外电子的排布规律。A-离子的电子层结构和氖原子相同,所以A是F。短周期元素中金属性最强的是钠,则B是Na。 C的原子核内质子数是B的次外层电子数的2倍,所以C是S。HF形成的化学键是极性键,其电子式为 。
。
有 A、B、C三种短周期元素。A-离子的电子层结构和氖原子相同;短周期元素中B的金属性最强;C的原子核内质子数是B的次外层电子数的2倍。试推断:
⑴.这三种元素分别是:A______、B______、C______;(用元素符号表示)
⑵. A的氢化物分子的电子式是__________;
⑶.C元素的最高价氧化物与足量NaOH溶液反应的离子方程式为___________。
【解析】考查原子核外电子的排布规律。A-离子的电子层结构和氖原子相同,所以A是F。短周期元素中金属性最强的是钠,则B是Na。 C的原子核内质子数是B的次外层电子数的2倍,所以C是S。HF形成的化学键是极性键,其电子式为。
2K2Cr2O7+![]() 2Cr2(SO4)3+2K2SO4+8H2O+3CO2↑
2Cr2(SO4)3+2K2SO4+8H2O+3CO2↑
(1)此反应的氧化剂为___________;氧化产物是___________。
(2)要使20mL1.0mol/LK2Cr2O7溶液被还原,至少要加入___________mL2.0mol/L的H2SO4溶液。
(3)H2SO4在上述反应中表现出来的性质是___________(填选项编号)。
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)在配平H2O2、KMnO4、H2SO4三者反应的化学方程式时,出现多套配平系数,如:
a.7H2O2+2KMnO4+3H2SO4====2MnSO4+6O2↑+K2SO4+10H2O
b.5H2O2+2KMnO4+3H2SO4====2MnSO4+5O2↑+K2SO4+8H2O
c.9H2O2+2KMnO4+3H2SO4====2MnSO4+7O2↑+K2SO4+12H2O
用![]() ;进行示踪实验(18O为示踪氧原子),证实生成的氧气全部是18O2,据这一实验事实,回答下列问题:
;进行示踪实验(18O为示踪氧原子),证实生成的氧气全部是18O2,据这一实验事实,回答下列问题:
①H2O2仅起还原剂作用的化学方程式是________________(填序号a、b、c)。
②研究三个化学方程式中各组系数的变化规律,写出符合该规律的一个新的化学方程式:________________________________________。
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(2)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液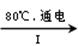 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
②Ⅱ中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
(3)一定条件,在水溶液中1 mol Cl-、ClOX-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。
①D是 (填离子符号)。
②B→A+C反应的离子方程式为 ;生成1molC时, KJ的热(填吸收或放出以及具体数值)
(1)下列关于工业生产说法正确的是 。(填序号)
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气
B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室
D.工业上采用电解熔融氯化铝的方法制取金属铝
E.石油裂化属于化学变化,主要目的是为了获得短链不饱和气态烃
(2)我国规定饮用水质量标准规定必须符合下表中要求:
|
pH |
Ca2+ 、Mg2+总浓度 |
细菌总数 |
|
6.5~8.5 |
< 0.004 5 mol·L-1? |
<100个·mL-1? |
以下是原水处理成自来水的工艺流程示意图:

①原水中含Ca2+ 、Mg2+ 、HCO3- 、Cl-等,加入石灰生成Ca(OH)2,进而发生若干复分解反应,写出其中的离子方程式(只要求写出两个): ; 。
②FeSO4·7H2O是常用的凝聚剂,它在水中最终生成 沉淀;通入二氧化碳的目的是 和 。
③气体A的作用是 ,下列物质中 可以作为气体A的代用品(填编号)。
a.ClO2 b.浓氨水 c.K2FeO4 d.SO2 e.漂白粉
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com