
题目列表(包括答案和解析)
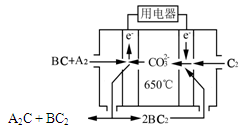
(14分)短周期主族元素A、B、C、D、E原子序数依次增大 , A是元素周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物分子含有相同的电子数。
⑴A、C、D形成的化合物中含有的化学键类型为 。
⑵已知:
① E-E→2E ?H=+a kJ/mol;
② 2A→A-A ?H=-b kJ/mol;
③ E+A→A-E ?H=-c kJ/mol;
写出298K时,A2与E2反应的热化学方程式 。
⑶在某温度下容积均为2 L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
| 平衡时n(X) | 0.5 mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 |  1 1 |  2 2 |  3 3 |
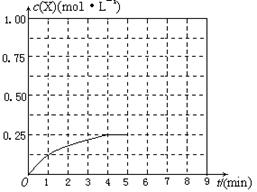
Ⅰ、(4分)将0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况
 下放出气体的体积和时间的关系如图所示。解释反应速率变化的
下放出气体的体积和时间的关系如图所示。解释反应速率变化的
原因: ;计算H2O2的初
始物质的量浓度为 。(保留两位有效数字)
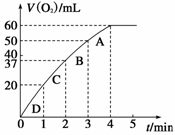
Ⅱ、(8分)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g),请填写下列空白:
xC(g),请填写下列空白:
(1)反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。
(2)若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。
(3)若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0,。请用p0、p来表示达平衡时反应物A的转化率а(A)为 。
(4)能够说明该反应达到平衡的标志是( )
A.容器内混合气体的密度保持不变 B.v(A)=3v(B) C.A、B的浓度之比为3:1
D.单位时间内消耗3n molA的同时生成n molB E.混合气体的平均相对分子质量
| |||||||||||||||||||||||||||||||||
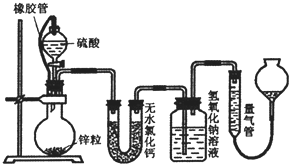 不同浓度的硫酸与锌反应时,硫酸可以被还原为S02,也可被还原为氢气.某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算.
不同浓度的硫酸与锌反应时,硫酸可以被还原为S02,也可被还原为氢气.某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com