已知①~④均为工业生产及应用的常见反应.其中常温下B、D、J、P气体,E为分子中原子个数比为1:l的液体.A的相对分子质量为120.(个别反应的产物已略去)

试回答下列问题:
(1)反应F与N溶液反应的离子方程式为
2Al+2OH-+2H20=2AlO2-+3H2↑
2Al+2OH-+2H20=2AlO2-+3H2↑
;
(2)反应⑤中当有1mol电子转移时,氧化剂消耗
17g
17g
g;
(3)反应④的离子方程式为
;如图2是该反应原理的示意图,该装置中使用的是
阳
阳
(填“阴”或“阳”)离子交换膜,图中从d处收集到的是
NaOH溶液
NaOH溶液
.
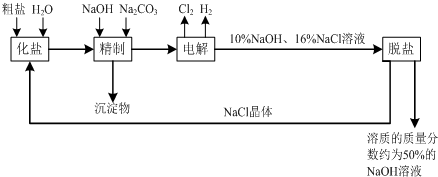
(4)工业上由D制取I的过程可表示为:

由D与B反应生成X的反应所用的设备是
③
③
;
①高炉 ②沸腾炉 ③接触室 ④分馏塔 ⑤吸收塔
已知400℃101Kpa时,2D(g)+B(g?2X(g);△H=-196.6KJ/mol,当2mol D与1mol B在该条件下反应达平衡时反应放热186.8KJ.在实际生产中综合考虑各种因素,为提高D的转化率,工业选择了以下哪些条件
④⑤⑥
④⑤⑥
.
①适当升高温度 ②增大压强 ③使用合适的催化剂 ④及时移走生成物
⑤适当增大B的浓度 ⑥将反应物与生成物在热交换器中进行热交换.

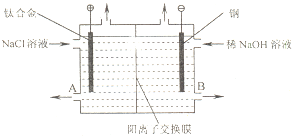 电解食盐水使用的离子交换膜电解槽装置如图所示.经过净化精制的饱和食盐水不断送入阳极室,向阴极室不断加入稀NaOH溶液.阳离子交换膜具有很好的选择性,它只允许阳离子通过.
电解食盐水使用的离子交换膜电解槽装置如图所示.经过净化精制的饱和食盐水不断送入阳极室,向阴极室不断加入稀NaOH溶液.阳离子交换膜具有很好的选择性,它只允许阳离子通过.

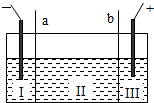



 则以下叙述正确的是
则以下叙述正确的是